Capítulo 8 Tipos de Desenhos Epizootiológicos
Entende-se por “desenho epidemiológico” a estratégia de coleta de dados que será utilizada na pesquisa (é claro que em nosso caso veterinário específico o desenho é dito epizootiológico). Tal estratégia de coleta de dados depende principalmente da pergunta em questão, a qual provocou hipóteses explanatórias, as quais demandam determinadas metodologias a serem utilizadas para comprovação. Todos estes fatores devem ter sido estabelecidos a partir do conhecimento prévio que haja sobre a matéria estudada naquele momento, o chamado “estado da arte” (vide Capítulo 5). Como dissemos naquele capítulo também, a aquisição de conhecimento científico epidemiológico é gradativa e retroalimentar: perguntas levam a novo conhecimento que suscita novas perguntas e assim caminha a ciência. Assim há uma certa ordem natural nos estudos epidemiológicos: primeiro nós (pesquisadores veterinários) observamos os fatores existentes no momento da análise que estão associados às doenças, como sinais clínicos, mortes, doença, parasitos, fatores de risco, em suma toda uma miríade de variáveis de suscetibilidade à doenças que já abordamos neste livro (vide Capítulo 4). Depois nós experimentamos com estes fatores, modificamo-los, de forma a comprovar que a doença (ou outra das variáveis acima citadas) comporta-se sob intervenção conforme o esperado (geralmente no sentido do controle da doença), respondendo adequadamente à minha pergunta inicial. É raro, e frequentemente infrutífero, que algum pesquisador comece um experimento mais elaborado sem algum tipo de conhecimento prévio sob a matéria em questão. Esta ordem natural da aquisição de conhecimento epidemiológico é traduzida pelo tipo de experimento que nós realizamos em cada etapa, da mais simples para a mais elaborada.
A Figura 8.1 apresenta um algoritmo decisório que indica o tipo de desenho epizootiológico a ser realizado dependendo de determinadas características da metodologia que será empregada pelo estudo. Os desenhos epizootiológicos nela presente são os mais corriqueiros para cada tipo de estudo desejado. Veja que desenhos mais elaborados e sofisticados podem ser utilizados (Stevenson (2021)). Cada um deste desenhos epizootiológicos apresenta vantagens e desvantagens diferentes entre si, já que sua execução é diferente e os resultados são de diferente ordem, como diremos a seguir.
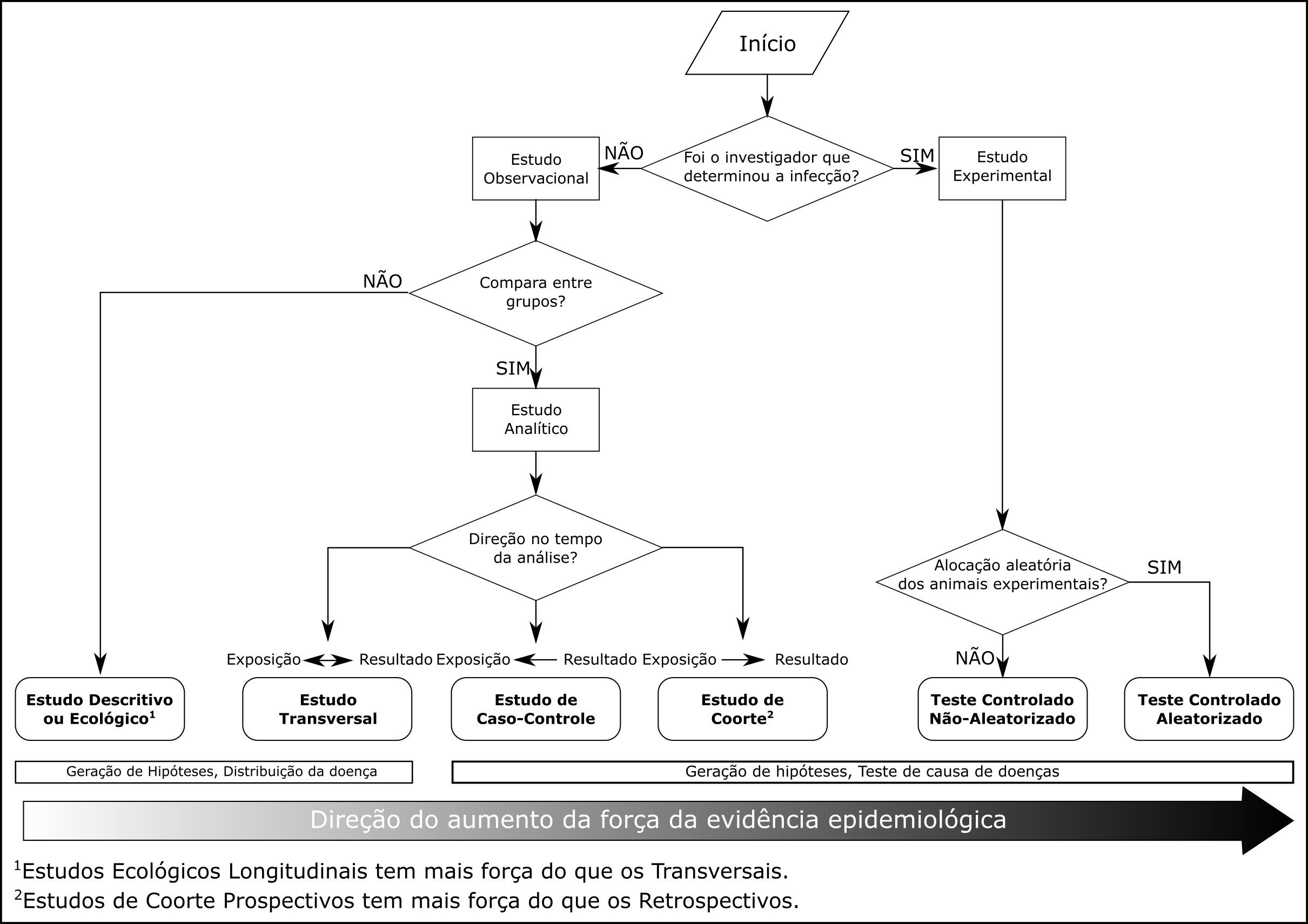
Figura 8.1: Algoritmo de definição do tipo de desenho epizootiológico indicado dependendo da metodologia proposta. Algoritmo baseado e modificado a partir de Grimes and Schulz (2002).
8.1 Desenho observacional ecológico
Esta á a forma de estudo mais básica. Não por isso tal desenho não possa fornecer informações importantíssimas sobre a região estudada. Em um estudo ecológico variáveis bóticas e abióticas são coletadas sem que necessariamente haja uma pergunta subjacente. Desta forma, um pesquisador veterinário (ou de outra formação, já que neste tipo de estudo vários campos de conhecimento podem ser explorados) pode estar coletando material biológico (como sangue, fezes, endo- e ectoparasitos) de animais de várias origens, fazendo necropsias em animais encontrados mortos ou atropelados, com o simples objetivo de identificar espécies, caracterização da fauna de vertebrados e invertebrados no local ou mesmo tipificação faunística e florística da área. Entretanto, tais informações podem servir de estudos mais aprofundados e que por sua vez, já versem sobre alguma pergunta específica a respeito do cabedal de dados reunidos no estudo ecológico. Em 1990 (Lourenço-de-Oliveira) foi o encontro casual no sangue de micos leões dourados da reserva de Poço das Antas de formas tripomastigotas metacíclicos típicos da infecção aguda com Trypanosoma sp. que provocou um estudo transversal posteriormente (Varella) e ultimamente uma compreensão mais completa da epizootiologia das infecções concomitantes de helmintos entéricos e Trypanosoma cruzi nas populações de micos leões dourados e também de de cara dourada (monteiro). Tais estudos entretanto são absolutamente inapropriados para responder perguntas mais elaboradas sobre intensidade da população afetada por determinado parasito ou mesmo inferir qualquer ideia de causalidade de doenças. Mas são bons pontos de partida na observação dos sistemas naturais.
8.2 Desenho observacional transversal
Neste tipo de desenho o pesquisador analisa uma amostra instantânea da população estudada. Por instantânea considera-se que, durante o intervalo de tempo da coleta dos dados/animais, o tamanho e composição da população permanecem inalterados. Portanto emigração, imigração, natalidade e mortalidade durante tal tempo são desprezíveis como fatores de modificação das características da população analisada (Capítulo 9). Atendidas estas condições, e sendo a amostra representativa e aleatória da população animal estudada (Capítulo 5), podem considerar que a frequência de ocorrência de sinais clínicos (doença) e parasitos ou fatores de risco (eventuais causadores ou acessórios à ocorrência da doença) na amostra é estatisticamente indistinguível da frequência destes parâmetros na população em geral.
Evidentemente, afora em situações de populações pequenas em laboratório, o “instantâneo” pode demorar alguns dias. Em linhas gerais, nenhum estudo transversal deve demorar mais de 7-14 dias sucessivos para coletar amostras biológicas dos animais estudados. Manter este limite de tempo garante que o intervalo de coleta seja menor do que o tempo geracional da maioria dos parasitos (afora microparasitos, como vírus e bactérias) e animais (roedores seriam os mais prolíficos, com um tempo geracional de 60-90 dias), é o limite de tempo imunológico entre reconhecer um antígeno e montar uma resposta imune (em torno de 14 dias). Este intervalo de tempo pode ser reduzido, mas geralmente é difícil também que consigamos amostras representativas com menos de 5 dias sucessivos de coleta.
Os estudos transversais são importantes desenhos de análise epidemiológica. Isto porquê, devido às características acima aludidas, eles geralmente são baratos e de rápida execução, e capazes de fornecer informações epizootiológicas sobre vários fatores de suscetibilidade simultaneamente, bem como fornecer uma análise dos parâmetros fisiológicos dos animais amostrados. Por estes aspectos eles são excelentes como geradores de hipóteses, base a partir do qual perguntas mais elaboradas podem ser estabelecidas. É comum por exemplo tabelas de contingência sejam construídas a partir destes estudos, na tentativa de encontrar correlações entre sinais clínicos de interesse e parasitos ou fatores de risco candidatos a estarem associados a tais sinais clínicos.
Veja que falo apenas de associação e correlação entre parasito e doença clínica, não em causa-efgeito. Estudos epizootiológicos de desenho transversal não são apropriados para o estabelecimento de relações de causa-efeito entre os parasitos candidatos e a doença ou sinal clínico de interesse. Isto porquê falta aos estudos transversais um aspecto fundamental no estabelecimento de uma relação de causalidade entre parasito (fator de risco) e a doença: uma sequência temporal de análise clínica que nos permite ter certeza de que a causa putativa (candidata – o parasito) estabeleceu-se no animal antes do efeito, doença clínica, começar a acontecer. Tal sequência causal é impossível de estabelecer-se em estudos transversais, já que nós vemos a doença clínica no tempo presente, mas não sabemos em que momento da vida do animal a infecção ocorreu. É falta lógica grave atribuir causalidade a determinado parasito sobre uma doença a partir de desenhos transversais.
8.3 Desenho Observacional Coorte
Desenhos observacionais do tipo coorte são os mais elaborados e difíceis de realizar, em comparação aos métodos anteriores. Esta maior dificuldade deve-se a dois aspectos preponderantes em qualquer estudo do tipo coorte: individualizar os animais e acompanhá-los no curso do tempo. Estes dois aparentemente simples procedimentos podem vir a envolver quantidades consideráveis de tempo de pesquisa e recursos financeiros.
Em termos de individualização animal, boa parte das espécies domésticas e a quase totalidade das silvestres são indistinguíveis em termos de indivíduos e seu sexo ao olho humano desarmado. É claro que existem características de pele, pelagem e plumagem que permitem, em algumas situações, individualizar animais de determinada espécie. Cães e gatos são individualizáveis por sua pelagem, mas Pastores Alemães nem tanto, requerendo outros métodos de individualização, como tatuagems e microchips. Vacas e cavalos passam pela resenha de suas características corporais tegumentares, como cor, aspecto, manchas, estrelas, entre outras características individuais que podem ser anotadas. Ariranhas (Pteronura brasiliensis) podem ser individualizadas pelo formato de suas manchas brancas no peito, baleias jubarte (Megaptera novaeangliae) pelo formato de suas manchas brancas na cauda, impressões digitais e da cauda preênsil individualizam primatas arborícolas ou terrestres. Cicatrizes, falta de orelhas, caudas cortadas, são todas características individuais que também são comumente utilizadas para individualização de animais. Entretanto, para a maioria das espécies e para muitas situações experimentais a marcação do animal deve ter uma permanência e uma capacidade de identificação melhores do que as acima aludidas (vide Capítulo 9).
Já no quesito acompnhamento do animal isto significa, no caso dos estudos de coorte, pelo menos uma recaptura do grupo de animais da coorte, idealmente duas ou mais recapturas para uma melhor compreensão da evolução da doença, seja no indivíduo, seja na população analisada. Isto resulta no fato óbvio que estudos de coorte são demorados. No caso de animais de vida livre, estações de captura devem ser realizadas a intervalos de tempo que sejam apropriados para o estudo da doença em foco. Já para animais tutoriados, de produção ou experimentais, o acompanhamento é muitas vezes mais fácil de ser realizado, devido ás características de alojamento de tais animais. Novamente, o intervalo de tempo deve ser apropriado à doença estudada. Assim, se o pesquisador estiver estudando uma população sob o risco de infecção com Dirofillaria immitis, um intervalo de acompanhamento de 6 meses seja apropriado, devido à lenta evolução da helmintose. Já se o foco fôr uma infecção em aves pelo vírus da Influenza aviária, um intervalo de análise mensal ou bimensal será mais apropriado à rápida evolução e transmissão desta virose. É claro que as limitações de tempo e recursos financeiros para a coleta do material biológico podem modificar tais cronogramas (vide 10).
Estudos de coorte podem ser realizados de forma prospectiva (dados são colhidos a partir do presente, na linha do tempo), a estratégia com maior poder experimental, ou de forma retrospectiva (analisando dados do passado para o presente), uma estratégia sujeita a maior incerteza nos resultados, mas ainda assim com bom poder experimental. Vamos a eles.
8.3.1 Estudo de coorte prospectivo
Para a realização de um estudo de coorte prospectivo o pesquisador parte de um grupo ou amostra experimental que estão tanto livres da doença como do parasito ou fator de risco candidato a causá-la. Observe que, quando da realização de um estudo que, como dito acima, é caro e pode ser demorado, o pesquisador já tem certamente um parasito candidato (selecionado em experimentos anteriores, geralmente transversais) a ser o agente causal da doença em estudo. Este grupo de animais deve estar sob risco de infecção com o agente candidato! Animais que, por qualquer motivo, não tenham risco de contrair a infecção, por não estarem expostos ou por serem impérvios à infecção.
O que espera-se constatar, a cada rodade de re-análises dos animais (seja uma ou várias), é quais deles tornaram-se infectados (positivos, pois) e quais apresentaram alterações clínicas e laboratoriais compatíveis com a doença estudada após a infecção. A partir deste tipo de análise sequencial podemos, finalmente, afirmar com certeza que determinada parasito ou fator de risco é causa da doença estudada. Isto porquê nós tínhamos animais saudáveis e não-infectados no começo do experimento, os quais foram apresentando a doença APÓS o estabelecimento da infecção. Tal relação sequencial no tempo, em vários animais do grupo experimental, caracteriza uma relação de causalidade entre o parasito e a doença clínica. Só agora o pesquisador pode concluir que a correlação de presença concomitante e frequente no hospedeiro do parasito e da doença (caracterizada nos estudos transversais), é devido a uma relação de causalidade entre o parasito e a doença. É claro que muitos estudos justamente refutam muitas vezes eventuais correlações entre fatores e a doença quando da realização dos estudos de coorte. Tais correlações são espúrias, acontecendo ao acaso (Browner et al. 2022).
8.3.2 Estudo de coorte retrospectivo
Este tipo de estudo é conduzido justamente ao contrário do anterior: são selecionados no presente animais que apresentem tanto a doença, quanto o parasito ou fator candidato, e recupera-se do passado informações clínicas e laboratoriais que sejam capazes tanto de indicar o momento que o fator se instalou no animal e quando a doença se estabeleceu. Para sermos capazes de recuperar tais tipos de informações, dados históricos sobre o atendimento do animal devem existir. Assim, é comum que este tipo de estudo estabeleça-se a partir de bancos de dados de pacientes existentes em hospitais veterinários, tanto de instituições de ensino como de atendimento em geral. O pesquisador procede então, no presente, à seleção de animais que existem em tais bancos de dados e que cumpram os requisitos que ele mesmo impõe à pesquisa. Tais requisitos devem incluir as informações históricas que aludimos acima: dados clínico-laboratoriais do animal (de um ou mais atendimentos) que sejam capazes de caracterizar a doença, e dados de diagnóstico parasitológico (ou do fator em questão) que permitam caracterizar quando tornou-se infectado ou sob a influência do fator.
Este tipo de desenho, embora possa fornecer dados de incidência (número de novos casos que ocorreram no período analisado, dentro da população analisada), tem limitações no estabelecimento de uma relação de causalidade, que pode ser feita, mas com determinadas ressalvas. Isto porquê é usual que os intervalos entre avaliações dos animais em tais estudos sejam diferentes, à medida que cada tutor, por exemplo, levava o animal para o acompanhamento da doença do animal. Outro problema é que há uma desigualdade entre as técnicas de diagnóstico da doença e do parasito, devido à realização em épocas diferentes, por técnicas diferentes, em laboratórios diferentes, o que introduz um ruído nos dados (vide Capítulo 5).
Um exemplo do uso de uma técnica de coorte retrospectivo foi no caso da busca de identificação causal da doença pandêmica que atingiu os anfíbios a partir da década de 80 do século XX (Daszak, Cunningham, and Hyatt (2003); Springborn et al. (2022)), hoje conhecida como quitridiomicose. A confirmação da etiologia da doença só foi capaz graças ao estudo de anfíbios depositados em coleções biológicas de museus através do mundo. Nestas coleções pode ser verificado na linha do tempo quando e quais espécies de anfíbios apresentavam a infecção pelo fungo E a doença que afetava sua pele. Pôde ser caracterizado então que a partir de determinado tempo no passado só uma espécie de anfíbio apresentava o fungo na pele: o Xenopus laevis. Esta espécie de anfíbio pôde então ser catacterizada como fonte do Batrachochytrium dendrobatidis que espalhou-se mundialmente, causando a morte de milhares de espécimes pelos 5 continentes (Vredenburg et al. (2013)).
8.4 Desenho observacional caso-controle
Um desenho do tipo caso-controle tem por objetivo acompanhar retrospectivamente pares de animais sendo um animal com a doença estudada (casos) e o outro sem (controles). A utilização da comparação entre estes pares de animais caso-controle é uma estratégia para a investigação de relações de causa-efeito entre parasito ou fator de risco em doenças crônicas ou de incidência baixa em uma determinada população animal. Nestes casos a utilização de um estudo de Coorte não é recomendada, pois tal iria requerer muito tempo e dinheiro para sua realização. Isto porquê são necessárias grandes populações amostrais para obtermos poucos animais positivos para o aspecto mórbido estudado.
Um fator preponderante nos estudos de caso-controle é a escolha cuidadosa de controles adequados para cada caso. Para que a comparação entre eles seja válida, é necessário que eles seja o mais iguais o possível à exceção da apresentação da afecção estudada. Por igual entende-se que estes pares de animais são idênticos para fatores que possam gerar variação na resposta à doença, como sexo, idade, raça, alimentação, ambiente, entre outros relevantes para cada caso em particular.
Assim um estudo de caso-controle começa no tempo presente, e destes animais são recuperadas informações clínicas e laboratoriais para o passado, tentando caracterizar se e quando o contato com o agente causal e a doença clínica investigados estabeleceram-se. Espera-se que, caso a etiologia da doença seja efetivamente a que está sendo investigada, que haja ocorrência da doença após exposição e forte associação entre o fator causal e a doença clínica (vide Capítulo 2.3) nos casos e não nos controles. Estudos de caso controle são sujeitos a erros similares aos de coorte retrospectivos, onde a acompanhamento clínico e laboratorial dos animais pode variar entre técnicas e métodos utilizados, bem como o intervalo entre análises pode ser diferente entre e intra pares.
8.5 Desenho experimental não-controlado
O desenho experimental mais simples é o teste não-controlado. Este tipo de experimento utiliza um determinado fator sobre uma população animal alvo, sem compará-lo contra um grupo controle, seja ele positivo ou negativo. Tal tipo de desenho é geralmente utilizado para testes terapêuticos, onde determinada droga é administrada a um grupo de animais e analisa-se os efeitos gerais do fármaco empregado. Como os animais são de uma população variada, considera-se o experimento não-controlado. Testes não-controlados são limitados em suas conclusões pelas grandes possibilidades de cometer erros de Tipo II, mas prestam-se bem para avaliações preliminares de determinados procedimentos terapêuticos.
8.6 Desenho experimental controlado
Os experimentos ditos ‘controlados’ referem-se ao controle da população animal utilizada e das condições do teste experimental (Browner et al. 2022). O objetivo é homogeneizar e reduzir a variabilidade biológica, representada pelo grupo experimental de animais, e ambiental, representada pelas condições do local onde o experimento será realizado. Ora, variabilidade biológica ocorre na mesma proporção da variabilidade genética. Destarte, controlando-se a amplitude da variabilidade genética dos animais experimentais pode-se estreitar ou alargar mais a variação biológica destes. Em experimentos controlados o pesquisador pode controlar do animal o sexo, idade, espécie, raça, linhagem ou tipo de animal, microbiota residente, estado hígido. Já para diminuir a variabilidade (ruído) introduzido pelo ambiente ele pode controlar a temperatura e umidade do ar, fotoperíodo, frequência e qualidade de oferta de água e alimentação, qualidade e composição do ar inalado, tipo de alojamento experimental, densidade de ocupação animal, composição etária do grupo experimental. Todos os fatores biológicos e ambientais acima citados sabidamente podem atuar como moduladores da suscetibilidade dos animais às doenças (vide Capítulo 4). Limitando-se a amplitude de variação destes fatores podemos evidenciar, sem tanto ‘ruído’ genético e ambiental, o fator experimental sob teste. Outros além destes podem ser introduzidos em dependência da pergunta epizootiológica a ser respondida.
Note-se que há uma penalidade de diminuir-se a variabilidade genética dos animais experimentais: as conclusões obtidas podem ser limitadas a tal grupo de animais, por vezes não sendo extrapoláveis para outros representantes do mesmo taxa, espécie ou raça de animais. Experimentos realizados com camundongos albinos consanguíneos machos de 6 meses podem ter seus resultados limitados à aplicação nestes grupos de animais. Para podermos extrapolar os resultados para outros grupos de camundongos precisaríamos corroborar as conclusões obtidas naquele grupo em outros experimentos, realizados por exemplo em camundongos albinos consanguíneos de qualquer sexo ou idade, e assim sucessivamente. Mas considerar os resultados obtidos naquele grupo específico de camundongos albinos como representativo da realidade fisiológica de camundongos normais seria um erro metodológico, que pode levar a consequências desastrosas para os animais.
As mesmas considerações devem estar em mente quando controlamos o ambiente dos animais. Esta homogeneização de condições ambientais permite caracterizar melhor os efeitos dos parasitos, fármacos e técnics sob teste, diminuindo a quantidade de animais nos grupos experimentais e a quantidade de repetições necessárias para chegar à mesma conclusão. Mas, novamente, tal ‘falseamento’ da realidade ambiental limita as conclusões obtidas àquelas condições experimentais, requerendo ulteriores experimentos para confirmar tais conclusões em grupos experimentais biologicamente mais diversos.
Um experimento controlado é sempre dividido em grupos experimentais. Estes grupos experimentais reproduzem em condições controladas os diferentes níveis de teste que o pesquisador deseja. Os experimentos mais simples envolvem dois grupos: um grupo controle negativo e um grupo experimental. O grupo controle negativo é constituído de animais normais, sem alterações, de características genéticas idênticas aos animais do grupo experimental, tratados da mesma forma, alojados e alimentados de forma idêntica. Já o grupo experimental será submetido à interferência do fator sob teste no experimento. Técnicas modernas de estatística tem recomendado grupos controle negativo menores do que os grupos experimentais, mais ainda quando o taxa escolhido é homogêneo geneticamente. Espera-se que a variabilidade biológica dos animais normais seja baixa e portanto um grupo controle negativo menor, apropriado.
Este desenho é adequado para análises estatísticas como testes t e análises de variância com um fator, porquê permite contrastar os resultados de animais em condições normais de saúde (grupo controle negativo) com os resultados de animais submetidos ao teste experimental (grupo experimental). Por contrastar entendemos comparar estatisticamente as variáveis biológicas analisadas no experimento, e verificar se a média dos resultados do grupo de animais experimentais é diferente da média dos animais do grupo controle (ou outro estatístico de escolha). Obviamente tal desenho permite testar apenas um fator no grupo experimental. O grupo experimental pode ter repetições, outros grupos identicamente tratados, de forma a aumentar o poder de diferenciação do fator testado (vide Capítulo 10).
Experimentos que envolvam mais de um fator frequentemente requerem mais de um grupo controle. Estes grupos controle a mais são necessários para diferenciar os efeitos dos outros fatores sob teste. Como exemplo, se um pesquisador precisar testar uma droga quimioterápica contra os efeitos mórbidos da infecção por um parasito, ele deverá estabelecer um grupo controle positivo que evidencie nos animais experimentais o efeito da infecção. Seu experimento assim seria constituído de um três categorias:
- Um grupo controle que avalia o efeito exclusivo do quimioterápico sobre os animais. Os animais deste grupo são tratados com o quimioterápico, mas não infectados. Este grupo é denominado ‘controle negativo’.
- Um grupo controle que avalia o efeito exclusivo da infecção sobre os animais. Os animais são infectados, mas não tratados. Este grupo é o ‘controle positivo’.
- Um ou mais grupos experimentais, que avaliarão o efeito do quimioterápico sobre o parasito infectado experimentalmente. Este(s) grupo(s) são compostos de animais infectados e tratados com o quimioterápico. A quantidade de animais por grupo e de grupos necessários depende do tipo e da variabilidade biológica da variável analisada (vide Capítulo 10).
Os contrastes neste tipo de experimento serão estabelecidos de forma a comparar: a) Animais apenas infectados contra os animais apenas tratados, de forma a demonstrar os efeitos da infecção sobre os animais experimentais. Espera-se que as variáveis biológicas e fisiológicas afetadas pela infecção com o parasito sejam diferentes estatisticamente entre os grupos. b) Animais infectados e tratados contra os animais apenas tratados. Espera-se que as variáveis analisadas sejam semelhantes entre si (e diferentes das dos animais apenas infectados), demonstrando a eficácia da droga contra os efeitos da infecção.
No caso do experimento acima, o pesquisador já tem indicações ou certeza que a droga quimioterápica é inócua para os animais experimentais. Caso esta certeza ainda não esteja estabelecida, o pesquisador poderia acrescentar um grupo controle negativo ao experimento: animais sem qualquer intervenção. Assim ele poderia controlar a inocuidade da droga contrastando os resultados dos animais apenas tratados contra estes animais normais, além de proceder aos outros testes. Veja que neste caso, há um outro fator sendo testado: a segurança biológica da droga. Assim, os animais apenas tratados não podem mais ser considerados um grupo controle, e sim um grupo experimental, onde repetições seriam recomendáveis e necessárias neste caso.
Sendo um experimento não-aleatorizado (não-randômico), a atribuição dos animais a cada grupo experimental não é ao acaso, mas dependente de algum fator outro, que é de escolha do pesquisador. Os animais experimentais podem ser atribuídos aos grupos por ninhada, todos os animais de um grupo tem o mesmo parentesco. Eles podem ser atribuídos por localidade, animais de um mesmo local pertencem ao mesmo grupo. É claro que estas distribuições carregam consigo um viés relativo a cada atribuição: se as ninhadas forem muito diferentes entre si o efeito do fator testado pode passar despercebido. Se as localidades tiverem condições locais muito diferentes o mesmo problema pode ser esperado.
Já nos experimentos aleatorizados a atribuição dos animais a cada grupo experimental é… aleatória. Há um sorteio que atribui cada animal a cada grupo experimental. Este sorteio pode ser efetuado de várias formas, desde que o resultado do sorteio seja aleatório. Assim desde a utilização de uma moeda honesta, onde cara e coroa decidem a atribuição a determinado grupo, até a utlização de sorteios por computador, onde a maioria dos pacotes estatísticos é capaz de gerar sequências randômicas apropriadas a cada experimento. Experimentos controlados aleatorizados são os que detem maior poder e consistência, sendo os recomendados para testes definitivos para estabelcer relações de causa e efeito.
Veja que todo o objetivo dos experimentos controlados é remover do conjunto de dados biológicos obtidos dos animais as fontes de variação que possam agir como fatores de confusão na identificação das relações de causa e efeito entre um patógeno e a doença clínica. Entretanto, mesmo com estes cuidados uma fonte de variação não-aleatória ainda está presente: o pesquisador. É para remover o efeito do pesquisador na execução do experimento, coleta e análise dos dados biológicos que os experimentos cego ou duplo-cego são planejados. O termo ‘cego’ refere-se ao fato de que o pesquisador, durante a realização do experimento desconhece de que animal provém o material que ele está inoculando ou analisando. Digamos que um pesquisador esteja analisando eletrocardiogramas (ECGs) de animais infectados ou não com um parasito que cause doença cardíaca. Em um experimento cego, o pesquisador quando fôr analisar o ECG ele deve desconhecer o estado de infecção do animal examinado. Desta forma ele não influencia a leitura do ECG por ‘esperar’ alterações nos animais infectados, ou não identificar alterações nos animais não-infectados.
Já experimentos duplo cego tipicamente são utilizados em avaliações de quimioterápicos e técnicas de diagnóstico, por exemplo. Neste caso o pesquisador que está administrando o fármaco ou executando a técnica de diagnóstico desconhece o que está aplicando, se droga ou placebo, ou desconhece o estado infeccioso do animal: ele está ‘cego’ para o que está executando. Assim seu comportamento e/ou discernimento não será afetado por saber o que está administrando/executando. O segundo ‘cego’, será quem irá analisar os exames e tecidos. Este também desconhece a que grupo o animal pertence, se ao grupo controle positivo, negativo, ou experimental. Desta forma seu análise não será corrompida pelo conhecimento da origem do animal. Desenhos experimentais controlados aleatorizados duplo-cego são considerados os mais refinados e com maior poder de discernimento estatístico dentro do estado da arte da ciência.