Capítulo 9 Definindo Parâmetros Populacionais
A composição, o tamanho, a densidade e a distribuição espacial da população de animais afetados por um determinado processo mórbido são componentes de informação importantes para estudar tal doença. Estas categorias de informações podem ser bem complexas, dependendo da diversidade da população afetada. Especificamente no que tange à composição da população afetada, esta pode envolver um ou mais taxa de animais que estejam doentes ou que participem na cadeia de transmissão da doença, e cada um destes taxa tem sua própria razão sexual (proporção entre os sexos), e todas as particularidades intrínsecas a cada espécie animal envolvida na enfermidade. Esta diversidade pode extender-se também para tamanho, densidade e distribuição da população de animais em análise. É claro que, gradualmente, com o progresso dos estudos epizootiológicos, variáveis não relevantes podem vir a ser excluídas como potencial causa ou fator de modulação da enfermidade.
As outras três variáveis populacionais relevantes para a compreensão da distribuição das doenças infecciosas entre animais, tamanho, densidade e distribuição da população animal, são definidas como:
Por Tamanho da população entende-se o valor integral de quantos indivíduos animais existem no agrupamento de área considerado.
Já a Densidade populacional é uma razão do tamanho da população dividido pela área considerada. Assim seus valores são sempre relativos à area analisada: população por metro quadrado, por hectare, por coluna de água, por caverna, por árvore em um hectare, e assim por diante. Sua unidade será relativa ao numerador e denominador utilizados: 3 aves por metro quadrado, 2 vacas por hectare, 100 peixes por um metro de coluna d,água, 250 morcegos por caverna de 50 m2.
Por Distribuição da população animal entende-se qual o padrão que os animais ocupam na área em que são encontrados, usualmente distinguidos entre padrão uniforme, quando os animais distribuem-se igualmente pela área, aleatório, onde os padrões de ocupação da área são randômicos, ou agregado, onde os animais tendem a serem encontrados próximos entre si.
Iremos aqui então citar técnicas simples de definição das variáveis acima descritas: Tamanho, Densidade e Distribuição da população animal. Animais em situações de cativeiro intensivo ou laboratorial são sempre bem conhecidos no que tange a tamanho, densidade e distribuição populacional, cujo controle è inerente a tal situações de criação. Nestes casos as contagens absolutas são utilizadas, já que sabe-se absolutamente quantos animais estão em determinado brete, gaiola, ou jaula, além de seu sexo, idade, background genético. Este não é o caso do estudo de animais ferais ou de vida livre, cujo grau de incerteza é naturalmente maior. Nestes casos as contagens parciais, amostras, são comuns, onde conta-se uma parcela da população animal e através de alguma forma de correção matemática, estima-se a população total.
Em qualquer método que o pesquisador venha a escolher, é necessário a definição clara de uma variável importante na aquisição de dados ecológicos: o esforço de captura. O esforço de captura é uma expressão de qual foi a proporção do fenômeno em estudo, ou seja, a própria presença do animal, que foi amostrada pela técnica de captura. Quanto maior o esforço, maior a possiblidade de captura. Logo, há um queda proporcional no grau de incerteza sobre a população quanto maior o esforço de captura. Normalmente também há um limite máximo de esforço, acima do qual o ganho de informação é desprezível para o esforço despendido. Obter um bom compromisso entre esforço e informação é o desafio do pesquisador que captura os animais. Esse compromisso pode ser baseado em experiências prévias de outros pesquisadores no assunto, publicações científicas e, evidentemente, o tempo e o dinheiro que o pesquisador tem disponível aquisição destas informações (Schwarz and Seber 1999).
As técnicas de contagem de animais que citaremos neste capítulo assumem três condições básicas para que os resultados finais sejam acurados:
Que a população animal esteja estável durante o período de contagem. Ou seja, natalidade, mortalidade, imigração e emigração são negligenciáveis durante o período de contagem.
Que todos os animais tem a mesma chance de serem contados ou capturados. Ou seja a probabilidade de contagem (ou captura) de algum animal ou grupo deles não seja influenciada pelo sexo, tamanho, coloração ou comportamento dele(s).
Que as marcas não sejam perdidas.
Respeitados estes requisitos, espera-se que os animais contados sejam proporcionais à população existente; que o estimado produzido esteja próximo do valor real. Em casos de animais raros a associação de técnicas de contagem pode gerar estimados populacionais mais corretos (Eggert, Eggert, and Woodruff 2003). Procure sempre manter os princípios acima em mente quando da execução ou análise de estimados contagem de populações animais (Lindberg 2012).
O processo de contagem de um determinado grupo de animais vai melhorando com o tempo, à medida que a espécie e o local vão sendo mais bem compreendidos. Esta melhoria gradual de compreensão da espécie e conhecimento do tamanho da população do animal sob estudo pode ganhar muito com replicações de contagens da mesma população animal, incluindo ou não a modificação de alguma variável de interesse. Assim, realizar a mesma técnica de contagem em estações do ano diferentes (ou anos diferentes), em locais diferentes, em uma espécie similar, ou mesmo variar a própria técnica de contagem nas situações acima descritas, pode contribuir com o ganho de informação sobre o tamanho real da população de animais, do qual todas as contagens relativas são estimados. O intuito é sempre comparar tais resultados com o objetivo de obter o melhor estimado populacional que possa orientar o estudo epizootiológico em curso. Notem que diferenças irão surgir entre estimados diferentes. O objetivo com estes estimados diferentes é sempre obter um intervalo de confiança, uma estimativa de uma faixa de valores em que você tem um determinado grau de confiança no resultado obtido (Hammond and Anthony 2006).
Um último aspecto que deve ser levado em consideração na escolha da técnica de contagem, e não menos importante, é que se estamos tentando caracterizar alguma doença em uma população animal, as técnicas de contagem que envolvem a captura do animal são vantajosas do ponto de vista Médico Veterinário, porquê permitem a coleta de informações e material biológico do animal capturado. Tal coleta, por um ponto de vista do estudo epizootiológico, permite diagnóstico clínico e laboratorial, levantamento parasitológico, avaliação de efeitos fisiológicos pelos quais o animal esteja passando, caracterização de sexo, em alguns casos a determinação da idade ou faixa etária, em suma, a captura é uma oportunidade de geração de conhecimento científico que não pode ser perdida. É recomendável, principalmente nos casos em que o estudo do local, animal ou doença estejam ainda em estágio inicial ou incipiente, que uma parcela das espécies e espécimes sejam eutanasiados e depositados em museus e coleções, como testemunho taxonômico e parasitológico da situação da comunidade local estudada.
9.1 Desenho experimental da captura
A primeira decisão que o pesquisador deve tomar no que tange à sua estratégia de captura é o desenho experimental que ele utilizará. Como vimos no Capítulo 5, tal decisão depende da pergunta Epizootiológica que está orientando a construção das hipóteses e, portanto, a metodologia a ser utilizada. A forma de captura, seja ela visual ou com armadilhas, pode acontecer com dois tipos de distribuição básica: o transecto linear (ou em linha) ou o quadrato (ou quadrado). O transecto linear é a distribuição mais simples para contagem de animais, e a captura é feita como o nome indica: o pesquisador caminha e conta quantos animais vê/captura sobre uma linha previamente definida. Já na distribuição em quadrato, mais exclusivamente executado com armadilhas, estas são distribuídas em uma grade de linhas e colunas. Outros desenhos de amostragem mais complexos podem ser necessários dependendo da espécie a ser contada, como desenhos radiais para répteis.
Em casos de estudos preliminares, geralmente é necessário primeiro um levantamento taxonômico e parasitológico, para conhecimento de quais espécies ocorrem, quais são mais comuns ou não no local, bem como quem parasita a quem no contexto da comunidade local. Tais levantamentos preliminares podem ser feitos com estratégias de transecto em linha, prescindindo do rigor de estabelecimento das armadilhas utilizado em um quadrato ou outros desenhos complexos. Já para a determinação acurada de Tamanho, Densidade e Distribuição Populacionais, geralmente os desenhos em quadrato são praticamente mandatórios, pois estes estão amostrando realmente uma determinada área espacial aonde os animais são capturados, e assim permitindo uma melhor aproximação dos valores reais destas variáveis populacionais.
9.1.1 Transecto linear
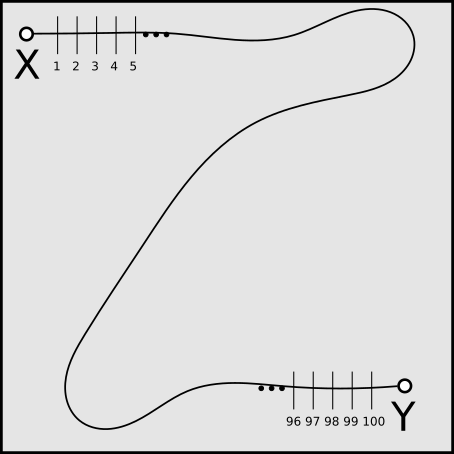
Figura 9.1: Diagrama com um desenho de captura em forma de Transecto Linear. Neste caso o pesquisador acompanha um trajeto de um quilômetro, durante o qual ele distribuiu 100 armadilhas de captura com 10m de intervalo entre cada uma delas, abertas por 12 horas durante a noite. Esforço de Captura por dia: 1200 armadilhas/hora. Se ele estivesse fazendo uma captura visual o esforço de captura dependeria do tempo gasto para percorrer aquele quilômetro. Se fosse 20 minutos, seu esforço seria de 3 km/hora. Uma rede de neblina para captura de aves e morcegos também é um transecto linear, sendo o esforço de captura calculado da mesma forma: tamanho da rede x número de horas abertas (multiplicado pelo número de dias abertos, se fôr o caso).
Durante a captura em um Transecto Linear o pesquisador captura, vê, fotografa ou ouve os animais de interesse, e assim os conta durante a distância percorrida. Em um transecto de linha o esforço de captura equivale à distância percorrida dividida pelo número de horas gastas percorrendo tal trajeto. Este transecto pode ser multiplicado pelo alcance esperado da linha de captura, transformando o transecto em uma área de captura total amostrada. Por alcance da captura entenda-se a distância máxima que você poderia capturar um animal a partir do seu transecto. Se fôr uma captura visual (uma contagem de animais com binóculo, p.ex.), esta seria a distância que o pesquisador consegue enxergar um animal no ambiente em que ele está. Se fôr com armadilha, seria a distância média que um animal seria atraído pela isca na armadilha colocada no transecto linear.
A Figura 9.1 apresenta um esquema de captura por Transecto em Linha. Digamos que um pesquisador coloque cem armadilhas de roedor sobre um transecto linear de 1000 m (10 m entre armadilhas), e assume que elas atrairão animais até no máximo 10 m de distância. Neste desenho, ele irá amostrar uma área equivalente a 10m∗1.000m=10.000m2, ou um hectare. Capturas conhecidas como pit-fall (Poços de queda, tradução literal) são muito utilizadas para répteis. Neste caso de transecto linear, uma lona plástica com cerca de 30-50cm de altura, colada ao solo, é extendida por uma extensão determinada pela pesquisa, geralmente pelo menos 50m lineares. Baldes plásticos são enterrados a intervalos da extensão da lona, a qual impede a passagem de pequenos répteis, conduzindo-os até a queda dentro do balde. Tal estimativa de densidade animal baseada em transectos pode ser altamente desviada, geralmente sendo utilizada como pré-amostragem, e não para determinação de abundância dos animais.
9.1.2 Quadrato

Figura 9.2: Diagrama com um desenho de captura em forma de Quadrato. São colocadas 100 armadilhas em uma grade de 10x10 armadilhas com 10 metros de intervalo entre elas, resultando em um hectare total de área amostrada. Tal quadrato deve ser rigorosamente estabelecido com auxílio de trenas, bússolas e/ou gps para que ao final a grade seja corretamente estabelecida. Esforço de captura equivale a 100 armadilhas por hectare.
A distribuição de armadilhas em quadrato tem por princípio o estabelecimento sobre a área a ser amostrada de uma grade formada pelas armadilhas, de forma a permitir a captura de qualquer animal de interesse residente naquela área (Figura 9.2). Tal grade, idealmente, deve manter linhas e colunas equidistantes entre si, variando de acordo com o tamanho do animal a ser capturado. Cada armadilha é posicionada no cruzamento de linhas e colunas, de forma que, em uma grade de 10 linhas e 10 colunas, 100 armadilhas seriam posicionadas. Para pequenos roedores, por exemplo, as armadilhas são distribuídas geralmente com 10 a 20 m entre linhas ou colunas. Em tal grade de 10x10 com 10m entre linhas e colunas, o pesquisador estaria avaliando uma área de 10.000m2 ou um hectare também. Para mamíferos de maior porte distâncias de dezenas até centenas de metros entre armadilhas podem compor um quadrato de amostragem de área muito maior. Quadratos para répteis assumem um formato diferente, pelas particularidades de captura deste táxon (Figura 9.3).
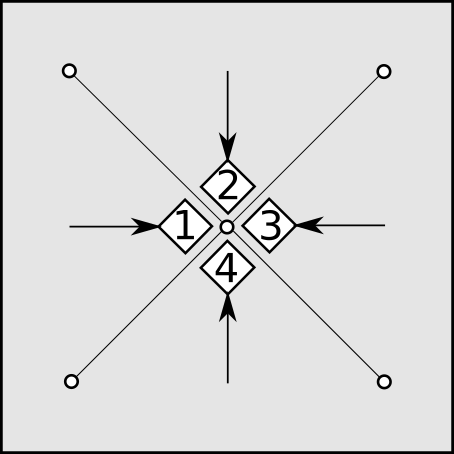
Figura 9.3: Diagrama com um desenho de captura em forma Radial. Este esquema é muito utilizado para Répteis e Anfíbios. Uma lona plástica é estendida em forma de cruz, com armadilhas na forma de “pit-falls” (poços de queda: baldes plásticos onde os animais caem e são retidos) nos vértices da cruz. Os animais são encaminhados na direção das setas pelas lonas plásticas até cairem nos baldes de captura. O esforço de captura é calculado pelo número de baldes abertos multiplicado pelo número de horas abertas (e dias).
9.2 Técnicas de contagem
Entre as várias técnicas de estabelecimento das estatísticas básicas das populações animais, vou aqui descrever as mais simples delas para a realização de contagens animais: a) Captura e Remoção; b) Captura e Marcação. Uma revisão das técnicas de captura especificamente pode ser vista em (Schwarz and Seber 1999).
9.2.1 Captura e remoção
Um segundo método de estimativa de dados populacionais é o método de captura e remoção dos animais capturados do local ou ambiente, útil para determinarmos o tamanho de uma população. Em linhas gerais, a captura com remoção é geralmente associada à eutanásia ou sacrifício do animal capturado. Diversos tipos de armadilhas podem ser utilizadas para capturar um animal (incluindo capturas com armas de fogo) e chamo vossa atenção para publicações melhores destinadas a “como capturar bem um animal” (Schemnitz et al. 2009; Shury 2014). Em alguns casos a remoção é seguida de translocação para área diferente ou cativeiro, para fins de conservação e/ou pesquisa. Uma grande vantagem da captura e remoção é que além de podermos determinar o tamanho da população animal local, também podemos necropsiar as carcaças dos animais eutanasiados e/ou sacrificados, adquirindo assim um grande número de informações parasitológicas e necroscópicas que nos ajudarão a caracterizar o(s) agente(s) parasitológico(s) envolvidos e as características fisio-patogênicas da morbidade que está acometendo os animais.
A lógica da contagem populacional por trás de tal método é que a população residente diminua gradativamente à medida que os indivíduos sejam capturados e removidos, e quando a população esgotar-se ou tenha diminuído muito eu terei uma ideia de quantos existiam no local no começo do processo de captura. Isso pode ser conseguido meramente somando o número de removidos, ou com alguma tipo de estimativa mais refinada (Figura 9.4).
Assim um pesquisador quer estimar a população de um roedor em determinado área natural. Ele abre 100 armadilhas por noite de captura, durante 5 noites seguidas. Seu esforço de captura é 100 armadilhas x 60 horas (5 noites x 12 horas por noite) = 6000 armadilhas/hora, ou seja durante este tempo total uma armadilha esteve aberta no local. Sua grade de armadilhas tem 10m entre 10 linhas e Colunas, conforme a Figura 9.2, painel B. A Tabela 9.1 mostra quantos animais este pesquisador capturou em cada dia de coleta.
| Dias de Coleta | Indivíduos Coletados |
|---|---|
| 1 | 4 |
| 2 | 7 |
| 3 | 6 |
| 4 | 3 |
| 5 | 0 |
| Total | 20 |
Note que cada animal capturado a cada dia foi removido da população existente, logo todos são indivíduos diferentes do anterior. Na Figura 9.4 pode ser visto a curva de animais capturados por dia, e a estimativa final da população de roedores presente inicialmente.
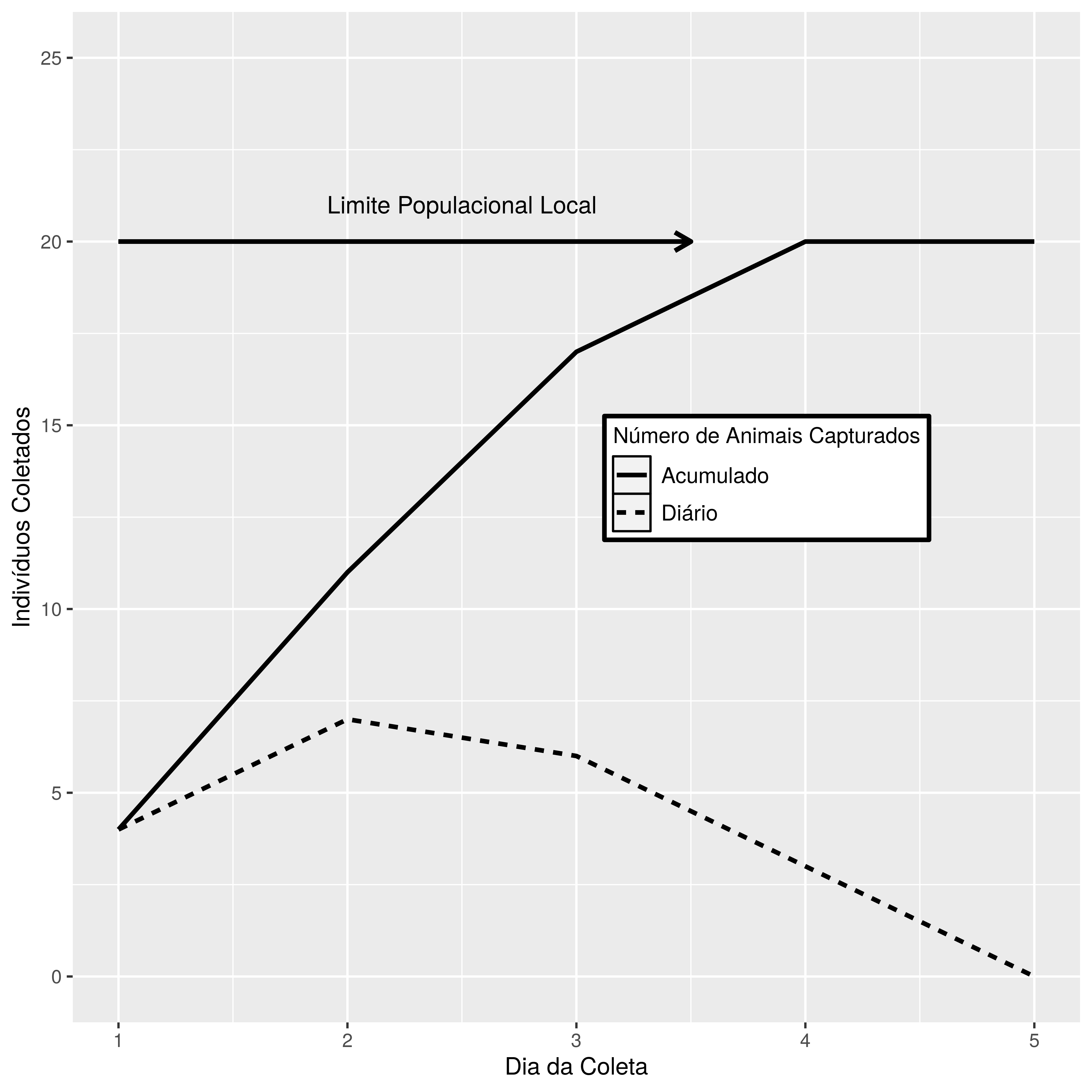
Figura 9.4: Gráfico mostrando a evolução Diária e a Cumulativa do número de animais capturados.
Cuidados importantes para que esta técnica funcione é que o tamanho do esforço de captura seja proporcional à população residente, ou seja, se existirem centenas de espécimes de roedores silvestres em determinado local e eu colocar apenas dez armadilhas para capturá-los, a população local nunca vai diminuir. Igualmente importante é que o esforço de captura seja feito de forma intensiva e em curto espaço de tempo, para evitar os efeitos confundentes de natalidade, mortalidade, imigração e emigração na população da área analisada. Por último o pesquisador deve ter em mente que, ao remover animais residentes em determinada região, local ou área geográfica, um vazio ambiental da espécie é criado, e naturalmente vai ser preenchido com outros animais da mesma espécie ou de um concorrente ecológico local. Tais perturbações na ecologia podem ter um efeito modificador na diversidade e abundância das espécies residentes, tanto de hospedeiros como de parasitos, com efeitos ainda imprevisíveis na dinâmica do(s) parasito(s) (e das doenças) que compõem a comunidade parasitária local.
9.2.2 Captura, marcação e re-captura
Uma outra forma de contar uma população animal, com menor impacto na população local e com possibilidades de estudo diferentes, são as técnicas em que, após capturado, um determinado animal recebe uma marca corporal e é devolvido à natureza. Esta marca permitirá que pesquisador identifique dali para a frente que este animal já foi capturado anteriormente e, se o tipo de marca permitir, até mesmo quem é o indivíduo. Os tipos de marcação que são eticamente aceitáveis para cada taxa animal são geralmente reguladas por lei ou por órgãos governamentais específicos. As normativas técnicas produzidas por tais organizações devem ser de conhecimento do pesquisador antes de escolher ou mesmo utilizar qualquer técnica de marcação animal.
O tipo de marcação tem que ser cuidadosamente escolhido, já que, idealmente, a técnica de marcação utilizada em qualquer animal deve:
- Não interferir com a sobrevida do animal, seja em crescimento, reprodução ou longevidade;
- Não ser perdida, apagada ou confundida com o tempo;
- Não interferir com a probabilidade do animal ser recapturado em futuras tentativas.
Cada uma destas assunções podem ser violadas de múltiplas formas. A experiência no passado nos permite uma escolha adequada hoje em dia, onde determinadas técnicas de captura são inócuas para os animais ou sua sobrevida (Brivio et al. 2015). Em outros casos pesquisadores identificaram efeitos negativos de marcação na sobrevida dos animais. Determinadas marcas são passíveis de perda ou esmaecimento no curso do tempo, impossibilitando a identificação do indivíduo, ou mesmo impedindo que ele seja caracterizado como recaptura. A marcação também pode interferir tanto negativa como positivamente na probabilidade de um animal ser capturado futuramente (Walker et al. 2012; Shury 2014). Desta forma, qualquer pesquisador tem por dever selecionar cuidadosamente o tipo de marcação que usará nos animais, de forma a eliminar ou minimizar efeitos modificadores da marcação por ele utilizada (Powell and Proulx 2003). Eu convido o leitor a referir-se a Silvy, Lopez, and Peterson (2005) para uma revisão sobre os problemas sobrevindos de determinadas técnicas de marcação.
Marcas podem ser de dois tipos: simples ou individualizantes. As marcas simples são geralmente feitas com tintas, etiquetas ou brincos simples, que não possuem nenhum tipo de recurso de numeração ou código individualizador. Já as marcas individualizantes, como o nome indica, tem em si númerações ou códigos que permitem ao pesquisador saber exatamente quem é aquele indivíduo capturado. Tais marcações são fundamentais para qualquer estudo epizootiológico que envolva a determinação etiológica causal. Isto porquê tais tipos de estudos exigem que saiba-se exatamente quando o animal tornou-se infectado ou doente no curso do tempo, e para tal é necessário saber-se quem é cada indivíduo.
Atualmente os microchips (transponder, microchip ou chip subcutâneo, chip RFID, entre outras denominações menos comuns) estão sendo utilizados frequentemente para individualização animal, permitindo a rastreabilidade do animal microchipado. Estes aparatos RFID (Radio-Frequence Ionized Device) nada mais são do que dispositivos capaz de serem ionizados por rádio-frequência, fornecendo um código de volta ao aparelho ionizador (leitor de microchip, sonda de leitura de chip, etc..) que é gravado de fábrica no chip RFID. Introduzidos subcutaneamente geralmente, ou em local corporal apropriado a cada taxa,estes dispositivos tem durabilidade praticamente ilimitada, são inofensivos aos animais e de tamanho tal que permitem a utilização em um variado tipo de taxa animais. O fator limitador destes aparelhos, que gradualmente deve diminuir, é que a leitura tem que ser realizada a distância relativamente próxima do animal, o que inviabiliza algumas utilizações que não permitem a aproximação, como os estudos de comportamento animal.
O método do cálculo do tamanho da população a partir de informações de animais marcados e recapturados, conhecido como método de Lincoln-Petersen, assume que: PT=AC1∗AC2AM2Onde PT: População Total; AC1: Animais capturados e marcados na 1a captura; AC2: Animais capturados na 2a captura; AM2: Animais marcados na 2a captura.
Este método segue o princípio de que os animais marcados se “diluirão” no restante da população total, e quando recapturados junto a animais não marcados em um segundo evento de captura, serão proporcionais à população em geral. Como um exemplo, digamos que um pesquisador abra 100 armadilhas em um dia e capture e marque 10 roedores de uma dada espécie. Em um segundo dia subsequente o pesquisador captura 14 animais, sendo destes 6 possuindo marcas do dia anterior. Veja que nesse caso é irrelevante saber qual indivíduo foi recapturado (marcas individualizantes são desnecessárias, pois), só interessa saber que ele foi capturado anteriormente ou não. Neste exemplo a população local estimada de tal espécie de roedor, baseada na Equação (9.1) acima é: PT=10∗146=23,33...≈23 animais Esta mesma estratégia pode ser usada com qualquer animal ou situação que não viole as assunções anteriormente descritas para esta estratégia de contagem. No caso de amostragens com baixos números, uma alternativa é o estimado de Chapman, o qual tenta corrigir distorções de amostras pequenas: PT=(AC1+1)∗(AC2+1)(AM2+1)+1Onde PT: População Total; AC1: Animais capturados e marcados na 1a captura; AC2: Animais capturados na 2a captura; AM2: Animais marcados na 2a captura.
A mesma formulação acima descrita pode ser utilizada para múltiplos dias de captura, onde a População Total (PT), será estimada com base na média dos estimados para dias sucessivos, conforme a fórmula (9.3) abaixo: PT=(AC1∗AC2)+(AC2∗AC3)+...AM2+AM3+...Atente-se ao fato que o número de animais marcados vai se acumulando a cada nova rodada de capturas, sendo incrementado pela diferença, em cada captura, entre o número de animais capturados e os já marcados. Assim, tome por exemplo a Tabela 9.2 referente à captura de exemplares de Nectomys squamypes, o rato d´água, durante uma rodada de 6 dias:
| Dias de Coleta | Indivíduos Coletados | Indivíduos Recapturados | Indivíduos Marcados |
|---|---|---|---|
| 1 | 4 | 0 | 4 |
| 2 | 7 | 2 | 9 |
| 3 | 8 | 4 | 13 |
| 4 | 5 | 3 | 15 |
| 5 | 2 | 2 | 15 |
| 6 | 3 | 2 | 16 |
| Total | 29 | 13 |
A população local calculada seria:
PT=(4∗7)+(9∗8)+(13∗5)+(15∗2)+(15∗3)(2+4+3+2+2)=28+72+65+30+4513=18,46≈19 roedores por hectare.
9.3 Distribuição espacial populacional
Devido aos seres biológicos serem influenciados por uma miríade de fatores que alteram seu genoma e, portanto, seu fenótipo, também a distribuição espacial dos indivíduos é modificada por tais fatores. Variáveis abióticas e bióticas (vide Capítulo 4) favorecem ou dificultam a ocupação do terreno, em suas três dimensões, gerando uma pressão seletiva que condiciona a distribuição espacial dos animais sobre o terreno. A distribuição espacial dos indivíduos de uma determinada espécie então pode ser classificado em três padróes básicos:
A. Agregado: um padrão em que os indivíduos formam agregados, mas estes agregados mantém uma distância de outros agregados de indivíduos. Tal padrão é muito comum na natureza, onde grupos familiares, por idade, por sexo formam tais agregados de forma permanente ou sazonal, como parte das estratégias de proteção, alimentação, reprodução destas espécies animais.
B. Aleatório: As distâncias entre os indivíduos tendem a se distribuir ao acaso, sem que os animais formem agregados permanentes, nem tampouco mantém uma distância regular entre os indivíduos.
C. Uniforme: A distância entre os indivíduos apresenta mínima variabilidade, gerando uma ocupação espacial regular e uniforme.
ANN=¯DoDeOnde Do: Média das distâncias observadas até o vizinho mais próximo; di: Distância do ponto i até o vizinho mais próximo; N: Número de pontos considerados.
Um dos métodos mais comuns de conseguirmos mensurar tais padrões é a Análise da Distância Média Até o Vizinho mais Próximo (“AVerage Nearest Neighbor Distance Analysis” - ANN), método usado em várias circustâncias (Clark and Evans 1979). Como o nome indica, a análise compara a média das distâncias observadas de cada indivíduo da amostra até seu vizinho mais próximo, contra uma distribuição hipotética do mesmo conjunto de pontos em completa aleatoriedade, conforme descrito em (9.4). Para o cálculo da média das distâncias observadas é utilizada a (9.5).
¯Do=∑nn=1diNOnde Do: Média das distâncias observadas até o vizinho mais próximo; di: Distância do ponto i até o vizinho mais próximo; N: Número de pontos considerados.
A distância média entre vizinhos da população observada é então comparada à distância esperada entre vizinhos caso o mesmo número de animais se distribuissem completamente ao acaso na mesma área considerada. Para o cálculo das distâncias esperadas é utilizada a (9.6).
¯De)=0,5∗√ANOnde De): Distâncias esperadas até o vizinho mais próximo quando em completa aleatoriedade; A: Área total ocupada pela população analisada; N: Número de pontos considerados.
O valor de ANN pode ser utilizado para gerar um escore z, e este escore z pode ser testado se é diferente de zero através do estabelecimento de um intervalo de confiança baseado em De±1,965. Caso o valor de ANN seja signficativamente abaixo de 1, a população segue um padrão Agregado. Caso ANN seja signficativamente acima de 1, a população segue um padrão Uniforme. Em caso de um valor de ANN não significativamente diferente de 1, a população distribui-se seguindo um padrão Aleatório. A Figura 9.5 demonstra os três tipos de distribuição espacial a que pode-se atribuir uma população de animais, Agregada, Aleatória ou Uniforme. O enquadramento em cada uma destas categorias é consequente ao resultado do valor calculado da Distância Média Até o Vizinho Mais Próximo em cada população.
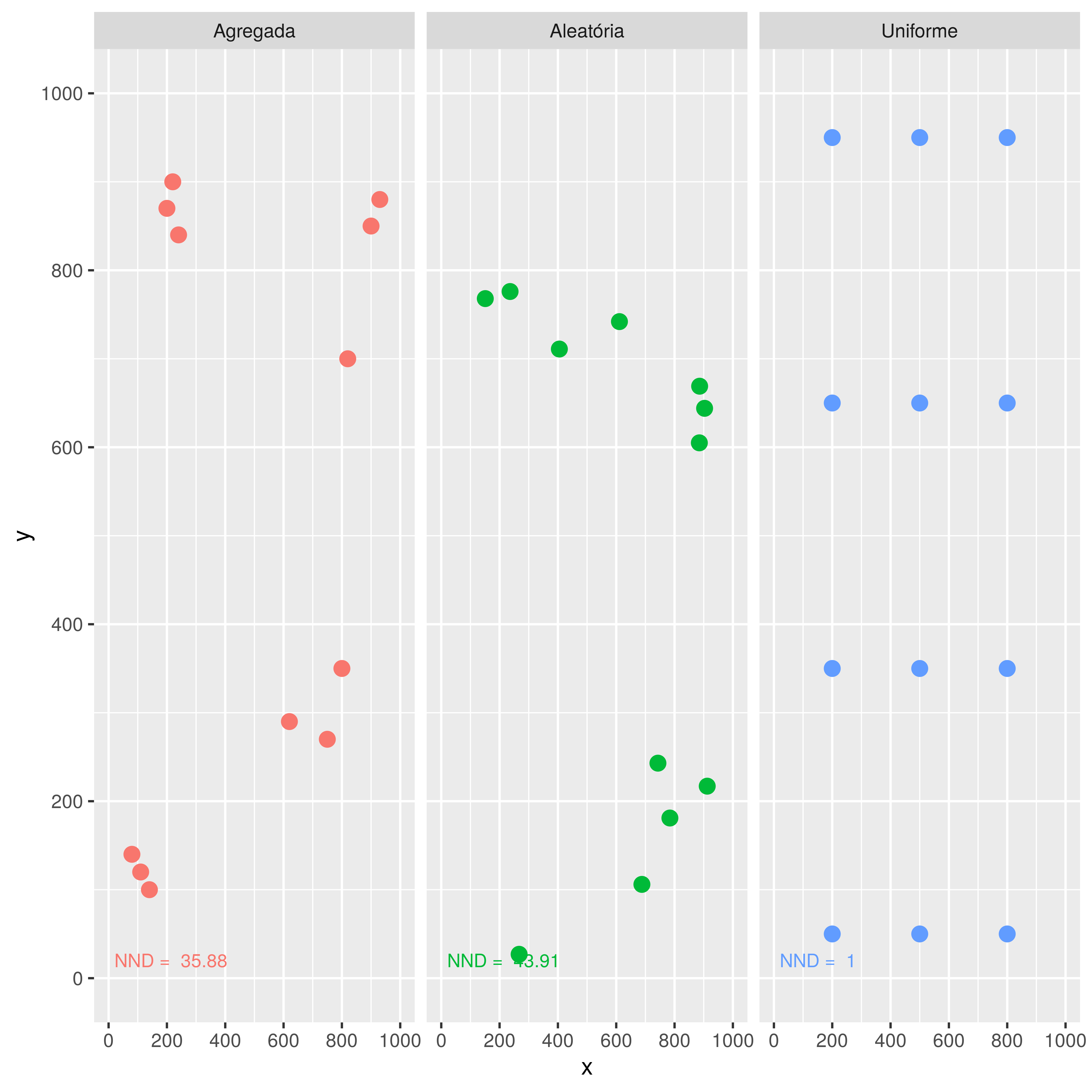
Figura 9.5: Diagrama exemplificando a hipotética distribuição de populações animais em três padrões diferentes: A) Padrão Agregado; B) Padrão Aleatório; C) Padrão Uniforme. Análise do NND (Nearest Neighbor Distance Analysis - Análise do Vizinho Mais Próximo) feita conforme (Clark and Evans 1979).