Capítulo 2 Epistemologia da Doença
A Epidemiologia estuda como as doenças se distribuem na população hospedeira. Doenças são consideradas um estado alterado do funcionamento orgânico normal. Portanto, para que eu possa caracterizar o que é doença (estado alterado), eu preciso saber o que é o estado normal do organismo, não-alterado, ou seja, como ele é com saúde. Portanto eu preciso definir Saúde. Contudo seja voltada mais para a espécie humana, seguindo o conceito de “Uma Saúde”, citarei a definição adotada pela Organização Mundial da Saúde (OMS) desde 1948:
“Saúde é o estado de completo bem-estar físico, mental e social, e não meramente a ausência de doença ou enfermidade.”
— Organização Mundial de Saúde (OMS, n.d., para. 1).
Este, por paralelismo, seria então o estado não-alterado de um animal. Por esta definição, um animal pode não apresentar doença e mesmo assim não ter saúde. Por esta definição, eu duvido que haja algum ser saudável no planeta Terra, tendo em vista a exigência de um estado quasi-nirvânico para saúde imposta. É interessante também que por esta definição “doença” seriam apenas afecções infecciosas, os aspectos físicos, mentais e sociais acarretariam apenas redução de bem-estar.
Embora não haja uma definição de saúde bem aceita para os animais, e aproveitando a referência feita a bem-estar, este seria o conceito análogo mais próximo à saúde. Broom e colegas tentaram abordar de forma científica este conceito, estabelecendo a seguinte definição (D. M. Broom 1986).
“Bem-estar é o estado em que o animal se encontra em relação à sua busca para satisfazer suas necessidades.”
— Donald M. Broom (1986)
O conceito de bem estar tal qual colocado por D. M. Broom permite então avaliação científica, porquê nós podemos avaliar quantitativamente os chamados “indicadores de bem-estar”, variáveis biológicas que oscilam em um animal ou população de animais e que refletem as condições de bem-estar do animal (D. M. Broom 1991). A ideia deste conceito baseia-se em que cada animal tem uma gama de necessidades diárias a serem satisfeitas, de ordem nutricional, social, comportamental (em paralelo ao psicológico humano), espacial, em suma, todas as necessidades que permitem viabilidade biológica e, em última instância, reprodução da espécie. Veja que as necessidades para “viabilidade biológica” são completamente diferentes para cada taxa animal, e dependentes de sua história evolutiva. Este conceito também considera o aspecto instântaneo do conceito de bem-estar, este sendo um estado fluido que é modificado pelas condições a que o animal é submetido durante a sucessão diária de sua vida. As condições do ambiente podem alterar-se radicalmente em instantes, modificando o estado de bem-estar de acordo.
Bem-estar então variaria de muito bom a muito ruim, um espectro de condições determinadas pela gama de necessidades que não estão sendo satisfeitas naquele momento. Caso o animal tenha satisfeitas várias de suas necessidades (mesmo que alguns poucos detalhes possam faltando), seu estado de bem-estar é muito bom. Já caso ele tenha muitas necessidades a serem satisfeitas (mesmo que algumas estejam atendidas), resulta em um bem estar muito ruim. Para que possamos situar a condição de bem-estar dentro deste espectro de muito bom a muito ruim, recomenda-se um painel de parâmetros indicadores de bem-estar, como o sugerido na Figura 2.1. A ideia é que os indicadores sugeridos avaliem comportamento, reprodução, alimentação, condição física e de saúde (aqui no sentido infeccioso tão somente) e sistema imune (D. M. Broom 1986, 1991). De acordo com a situação do animal em cada variável do painel nós podemos inferir sua condição de bem-estar. Dependendo da espécie animal e situação outros parâmetros podem substituir ou adicionar informações a tal painel.
A importância de avaliarmos tal painel de parâmetros reside na própria inter-dependência deles. Doenças infecciosas frequentemente resultam em efeitos de ordem nutricional, social, comportamental e outros. De igual forma, necessidades nutricionais, sociais, comportamentais, não ou parcialmente atendidas podem acarretar facilitação da ocorrência de doenças infecciosas, pelo comprometimento dos processos de tolerância e resistência orgânica. Inclusive muitas vezes infecções podem ser detectadas precocemente por alterações nos parâmetros de comportamento ou sociais do animal. É normal que durante um dia comum qualquer organismo biológico tenha necessidades não-satisfeitas momentaneamente, mas não necessariamente ele vai ficar doente, ou ter sua viabilidade biológica ameaçada por isso. Entretanto, a reação de estresse agudo ou crônico são suscitadas por necessidades não atendidas, justamente na tentativa de satisfazer tais necessidades. Novamente, quanto mais necessidades não-atendidas, maior o grau de estresse provocado no animal (Veissier and Boissy 2007).
O conceito de bem-estar acima apresentado vem sendo desafiado por outras abordagens e críticas (Carenzi and Verga 2009; Donald M. Broom 2011). Mas na minha compreensão ainda é a abordagem atual mais apropriada para avaliarmos o bem-estar animal, e o conceito de bem-estar é frequentemente recomendado para avaliar se o trato dado a um animal ou população é adequado. Note então que “doença” é apenas um componente do rol de parâmetros recomendados para avaliação de bem-estar. Logo, estar em saúde é mais do que não estar doente, mas estando doente o animal tem uma redução de bem-estar que, caso não resolvida, acarreta um comprometimento da sua saúde em última instância, por diminuir sua capacidade de adaptação ao ambiente.
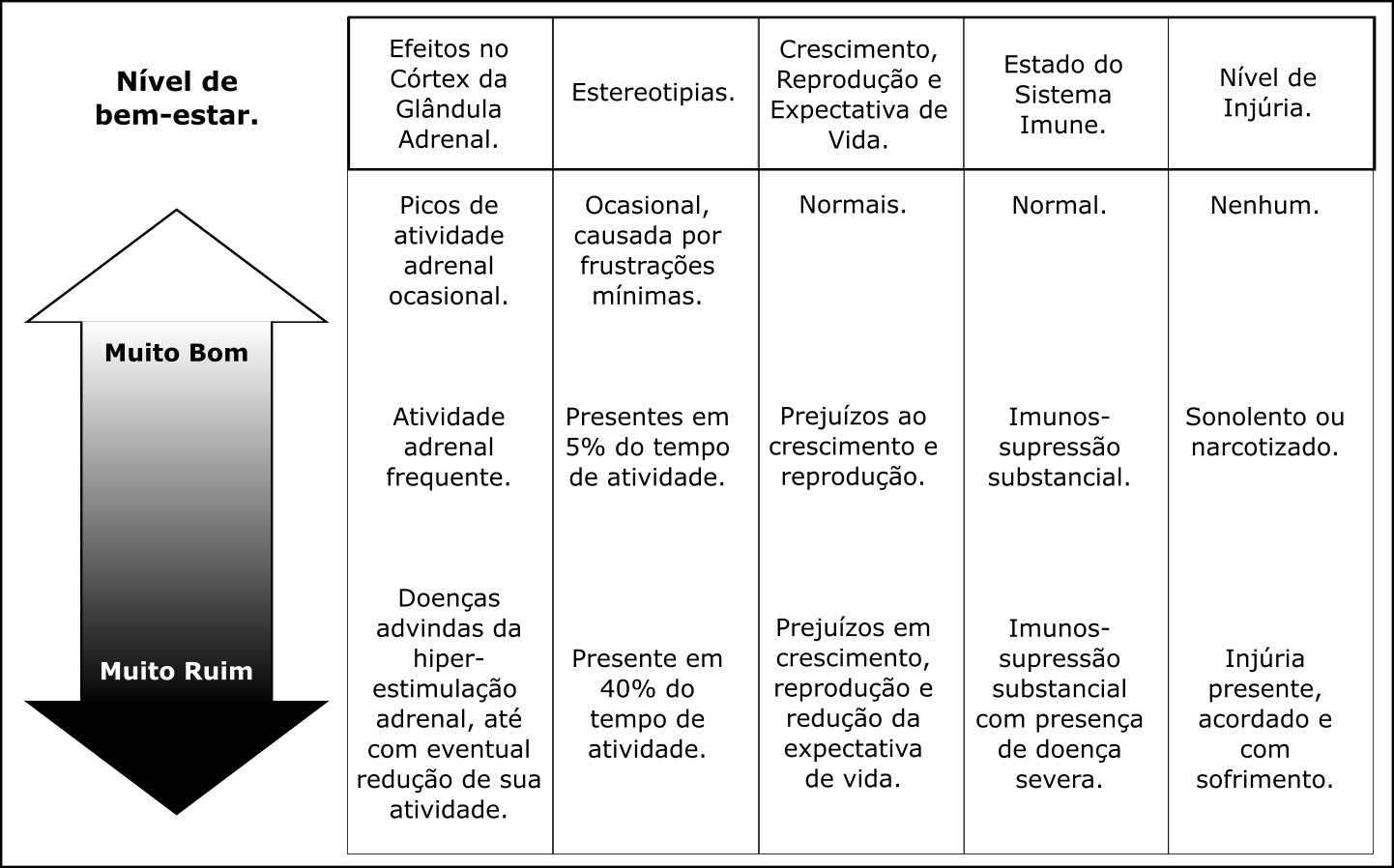
Figura 2.1: Painel de indicadores de bem-estar. Cada coluna apresenta um parâmetro diferente e graus de resposta esperada que podem ser utilizados para avaliar o grau de bem-estar em que um animal ou população animal se encontra. Traduzido e adaptado de D. M. Broom (1986).
Assim, quando podemos dizer que um animal está doente e por conseguinte considerar que ele está submetido a uma redução de bem-estar? Uma definição de doença frequentemente utilizada é a apresentada por Wobeser (Wobeser 1994):
“Any impairment that interferes with or modifies the performance of normal functions, including responses to environmental factors such as nutrition, toxicants, and climate; infectious agents; inherent or congenital defects, or combinations of these factors.”
— Gary A. Wobeser (1994)
Esta definição de doença2 também é um tanto quanto abrangente no que considera doença. Por esta definição qualquer animal (ou mesmo pessoa) estará doente a qualquer momento. É virtualmente impossível que um animal não seja modificado em sua performance em qualquer momento de sua vida diária. Estas modificações advém não só de variáveis abióticas (intempéries, umidade do ar, temperatura, luminosidade; uma discussão destas variáveis dar-se-á no Capítulo 4), como por variáveis bióticas. Esta modificação dos sistemas orgânicos via biótica dá-se, no mínimo, porquê vertebrados albergam uma população de microorganismos que é pelo menos igual ao número de células do próprio organismo hospedeiro, modificando-o positiva ou negativamente, constantemente (Sender, Fuchs, and Milo 2016). Herbívoros que digerem por fermentação bacteriana tem microbiotas com populações maiores ainda em relação ao número de células hospedeiras (Morgavi et al. 2013; Julliand and Grimm 2016; Gruninger et al. 2019), em que pese o pequeno número de espécies em que tal informação é disponível. Indiferente ao número, é cada vez mais claro que a composição da microbiota por si só modifica a adaptação dos sistemas fisiológicos dos hospedeiros ao ambiente (Suzuki 2017; Gould et al. 2018) e mesmo seu comportamento (Adamo 2013; Archie and Tung 2015).
Para encerrar este assunto e deixar claro nosses termos de conversa, durante este livro usarei os seguintes conceitos:
Saúde é um componente do bem-estar animal, expresso pelo adequado funcionamento dos tecidos orgânicos do animal, tendo por referência o que é normal para a espécie.
Doença é um estado orgânico alterado, causado por modificadores bióticos e abióticos que interferem no adequado funcionamento dos tecidos orgânicos, e capaz de ser detectado por anormalidades em exames que avaliem o funcionamento dos tecidos afetados.
Veja que por estas definições um animal pode:
Estar com bem-estar bom, mesmo estando doente (desde que a doença seja leve/moderada).
Estar infectado sem estar doente: a infecção não causa alteração orgânica detectável/significativa.
Ficar doente induzido por queda na qualidade dos níveis de alojamento e alimentação, que acarretam modificações comportamentais negativas, comprometendo o sistema imune e a capacidade de controle de infecções, acarretando doença por fim.
Não é fácil discernir um animal doente de um animal com saúde apenas pela inspeção visual do mesmo, e que mesmo com exames laboratoriais que avaliem seus sistemas orgânicos (análises de expressão gênica, de células e de tecidos) como podemos identificar um resultado anormal de um normal? A resposta é sempre a mesma: por comparação. Comparamos comportamento, aparência, cor, tamanho, aspecto, valores laboratoriais ou qualquer variável orgânica entre animais sabidamente normais com os resultados de animais em que suspeitamos doença. No Capítulo 7 eu apresento a abordagem matemática utilizada usualmente para a definição do que é normal ou doente em relação às variáveis biológicas que nós comumente analisamos nos animais.
O que deve estar claro para o Médico Veterinário é que saúde e doença são estados fluidos, um espectro que varia como varia o espectro de bem-estar: de muito ruim a muito bom. O estado de saúde do animal pode ser bom hoje, mas ir piorando gradativamente por ação de algum fator que modifique sua saúde. De forma análoga inversa, o estado de doença de um animal hoje pode ser grave, mas ele pode ir melhorando gradativamente devido ao efeito de algum fármaco ou intervenção Médico Veterinária ou mesmo ação intrínseca do sistema imune. Assim, embora declaremos em um consultório ou situação de análise de saúde animal “ele está doente”! tal declaração é referente a uma situação instantânea, que pode ser modificada sob influência de muitos fatores, iatrogênicos ou não.
Esta fluidez na suscetibilidade à doenças infecciosas, ou em outros termos, variação no estado de saúde causado por microorganismos potencialmente patogênicos foi sendo traduzida gradualmente na forma de três mecanismos. Estes três mecanismos são componentes da competência imunológica do hospedeiro, e são utilizados para expressar sua suscetibilidade a um determinado microorganismo (Best, White, and Boots 2008; Råberg, Graham, and Read 2009; Tadiri, Fussmann, and Scott 2021):
Mecanismos de Resistência reduzem a carga do parasito, ou impedem-no de realizar estágios do seu ciclo ontogênico dentro deste hospedeiro.
Mecanimos de Tolerância limitam o impacto do parasito dependendo da carga parasitária, ou seja há uma correlação inversa entre carga parasitária e o nível de tolerância.
Resiliência é a capacidade do organismo do hospedeiro em desempenhar independente de carga parasitária, ou seja o hospedeiro é impérvio à infecção em qualquer nível de parasitismo.
Conjuntamente com os microorganismos capazes de provocar infecção e/ou doença clínica nos animais, podem estar associadas variáveis abióticas que podem modificar a probabilidade ou severidade de apresentação de uma doença infecciosa. Estas variáveis são consideradas um fator de risco. Poeira, radiação, compostos químicos tóxicos voláteis ou de contato, produtos de desinfecção, vapores, fumos, todos são fatores que podem modificar a apresentação clínica e o perfil de infecção de um determinado microorganismo, tornando-o patógeno.
Um último aspecto deve ser aqui abordado: que termos devemos utilizar para designar um animal que esteja doente? Embora a palavra “doença” seja a mais comumente utilizada, outros termos podem ser utilizados como “morbidade” (um sinônimo direto de doença), “afeccção”, “enfermidade” ou “moléstia”. Rezende (Rezende 2014) fez uma análise histórica e linguística da origem dos termos utilizados na literatura médica para designar tais estados. Adaptando as definições a partir de seu texto:
Doença: Palavra oriunda do latim dolentia, que significa dor. O termo pressupõe pois tal sensação desagradável, oriunda de alterações orgânicas prejudiciais ao animal.
Enfermidade: Palavra originária do termo latino infirmus, que significa fraqueza, debilidade. Deveria ser utilizada para designar a inação do animal proveniente do quadro da doença.
Moléstia: Também originária do latim molestia, designando o mal-estar do animal provocado pela doença.
Afecção: A palavra de raiz latina affectio significa a modificação do ânimo ou estado de espírito causada pela doença.
Como Rezende (2014) deixa claro, embora de etimologias diferentes, hoje em dia é aceita a sinonímia entre estes termos. O que não deve nunca acontecer é a utilização do termo “patologia” como substituto ao termo “doença”. Patologia é o estudo da doença, e não a enfermidade, morbidade, afecção ou moléstia em si.
2.1 Definindo a normalidade
A análise clínica moderna então é baseada em uma comparação do que consideramos que seja normal para um dado animal ou população, com os resultados das variáveis utilizadas para inferir a saúde dos animais examinados (ou o bem-estar, conforme o caso). Resultados situados fora do que é considerado normal são considerados evidência de alteração mórbida ou doença. Embora esta técnica seja considerada bem sucedida, corretos padrões de normalidade devem ser utilizados, sob risco de confusão de animais doentes com saudáveis. Se, por exemplo, formos comparar resultados de hemograma de cavalos de passeio sem raça definida com os padrões de normalidade de cavalos Puro Sangue Inglês de corrida, todos os indivíduos parecerão anêmicos (Balarin et al. 2001; Ramires et al. 2019). Na pesquisa científica com animais silvestres frequentemente o animal que estamos examinando ou coletando material biológico tem grandes lacunas de conhecimento sobre ele, inexistindo padrões de normalidade para a espécie. Já em animais de laboratório, linhagens de camundongos consanguíneos, os “Padrões de Normalidade” são praticamente linhagem-específicos (Silva‐Santana et al. 2020). Raças de ovelhas podem ter resultados “normais” muito diferentes entre si, dependendo da altitude que são criadas usualmente (Banchero and Grover 1972), e tais adaptações afetam o genoma dos animais (Gorkhali et al. 2016). É por isso que advogo a utilização do termo “Padrão de Referência” ou “Nível de Referência” em preferência a “Padrão de Normalidade”. No primeiro, estaremos contrastando estatisticamente os resultados coletados contra um determinado valor de referência. No segundo, está implícita a ideia de que o “Normal” é estático, é não uma resultante às diversas condições que podem afetar os resultados biológicos dos animais analisados. O que nós esperamos é que nosso “Padrão de Referência” seja uma aproximação adequada do que é o “Normal” para o indivíduo ou população em questão.
Tal normal então é o Controle Negativo em nosso experimento. Este grupo de animais que serão nossa referência de comparação comporão nosso controle negativo e devem, idealmente, ser livres de influências orgânicas oriundas de fatores que possam gerar ruído nos dados, comprometendo nossa capacidade de identificação do anormal, ou seja da doença. Assim, bom alojamento, boa nutrição, estar livres de parasitos sabidamente patogênicos, entre outros fatores que sejam inerentes ao experimento, são condições básicas para que possamos definir adequadamente quais seriam os níveis e limites fisiológicos característicos de uma referência de boa saúde. Tal animal estará em condição ótima de bem-estar, apropriado pois para o estabelecimento dos padrões de referência.
2.2 Identificando a doença
A detecção inicial de qualquer doença em um animal é invariavelmente clínica. Primeiro identifica-se uma alteração clínica no animal, e depois colhemos material biológico para elucidar a enfermidade que o afeta. Note que a apresentação clínica de doenças severas e agudas facilita seu diagnóstico e identificação etiológica, o que é mais difícil nas morbidades crônicas e/ou leves. As primeiras são identificadas facilmente, já que afagia, apatia, diarreias e pneumonias graves, entre outros, são sinais clínicos bem evidentes quando intensos. A investigação epidemiológica de seu agente etiológico é amiúde rápida, por correlação simples dele com os sinais clínicos graves e posteriormente por métodos de identificação causal. Já nas enfermidades crônicas/leves às vezes anos de estudo são necessários para identificá-las frente ao “ruído” gerado por outras enfermidades e fatores durante a progressão lenta de tal doença.
Tais variáveis clínicas são frequentemente discretas (resposta tipo sim ou não, presente ou ausente, ou graus discretos de análise - não, pouco ou muito aumentado) o que facilita a definição do que é normalidade. Digamos, não é normal um cão ter diarreia. Logo, qualquer cão que apresente diarreia está doente, com uma morbidade, uma afecção. Mas mesmo neste exemplo simples um Veterinário pode ter dificuldade em caracterizar a diarreia no animal. Ela pode ser leve ou intermitente e escapar à observação. A experiência do profissional Médico Veterinário também conta muito para a identificação de sinais clínicos. Um Médico veterinário inexperiente pode ter dificuldades de diferenciar a normal defecação de uma ave de um bolo fecal diarreico. Já no profissional mais treinado e/ou experiente, com algum tempo de atuação, isto ocorrerá facilmente, devido ao natural treinamento no reconhecimento visual e interpretação do sinal “diarreia em aves”.
Já exames laboratoriais realizados sobre material biológico em geral são avaliados através de variáveis contínuas (qualquer variável que seja estimada através de um número Real). Para estas, a definição do “normal” não é tão lógico e direto, sendo obrigatória uma abordagem estatística, devido à intrínseca variabilidade biológica gerada pela ação de inúmeros fatores bióticos e abióticos sobre cada organismo (Voelkl et al. 2020). Nestas situações, o resultado de um exame estará normal se situar-se dentro de uma faixa de valores em que os resultados são considerados “normais”. Esta faixa de valores é definida a partir de todos os resultados apresentados pelos animais, excluindo-se os valores extremos muito acima ou abaixo da média (para variáveis com distribuição Gaussiana, Normal), ou dos quartis centrais (para variáveis não-Gaussianas).
Nossa capacidade diagnóstica hoje em dia permite produzir uma grande gama de informações clínico-laboratoriais sobre os animais, que devem ser adequadamente somadas ào profissional Médico Veterinário bem educado e treinado para produção de ótimos diagnóstico, tratamento e prevenção de doenças para os animais sob seus cuidados. Esta é a base da Medicina Baseada em Evidências (“Evidence Based Medicine”): o bom profissional de saúde atuando sempre baseado em evidência científica clara de que determinado fator ou agente etiológico está causando alterações mórbidas, de que determinado medicamento provoca melhora clínica, de que uma certa técnica diagnóstica é capaz de identificar o microorganismo alvo, e assim sucessivamente. Embora devamos sempre manter uma margem de dúvidas para fatores que gerem efeitos eventualmente ainda não caracterizados, como princípios ativos ou sistemas terapêuticos diferentes, tais fatores, quando sucessivamente rejeitados pela evidência científica, não devem ser utilizados (Burns, Rohrich, and Chung 2011).
Existe um princípio lógico de que ausência de evidência de efeito não deve ser confundido com evidência de ausência de efeito. Considere que eu esteja executando um experimento testando se uma determinada bactéria é sensível a um determinado antibiótico. Caso meu experimento tenha como resultado que houve ausência de evidência de efeito do antibiótico sobre a bactéria, eu posso ter cometido um erro estatístico de Tipo II - deixar de encontrar um efeito que realmente existia. Minha possibilidade de cometer tal erro vai depender de minha escolha de Poder do Teste, que geralmente deseja-se que esteja acima de 80%, pelo menos. Sim, porquê meu teste estatístico é exigente para que você não cometa um erro de Tipo I - considerar que o antibiótico atue contra a bactéria, quando ele não funciona! A maioria dos testes estatísticos é ajustado para que isto ocorra apenas em 5% dos casos. Pelo princípio da preucação, o teste estatístico corre um maior risco de não assinalar um antibiótico que funcione, do que de indicar como eficaz droga que não o seja. Assim, é lícito que um pesquisador suspeite em um experimento que haja um efeito significativo em questão, mas seu teste estatístico falhou em caracterizá-lo. Repetir o experimento com técnica e/ou métodos mais refinados para detecção do efeito em questão, aumentar o número experimental, ou uma combinação destas abordagens seria a solução para tal pesquisador.
Uma das qualidades do moderno Método Científico é sua capacidade de detecção de erros de ordem intencional e não-intencional. Devido à combinação da revisão pelos pares (que deve ser feita com cuidado e correção metodológica e ética) e divulgação pública dos resultados (tornando-os acessíveis ao escrutínio da comunidade científica), a ciência mantém seu controle de qualidade. Devido às características da abordagem estatística utilizada para caracterização dos efeitos, é normal que, em face a um efeito significativo, os testes apontem isto em pelo menos 95% dos experimentos, mas que possam apresentar resultados contraditórios em até 5% destes. Em caso de efeitos sujeitos a interferência de muitos fatores, os resultados dos experimentos podem apresentar contradições em percentuais até maiores. Na evolução da construção do método científico então, ficou claro um aspecto: pelo menos no âmbito das ciências biológicas, um experimento isolado nada prova (Burns, Rohrich, and Chung 2011). Ele acumula evidências do efeito em questão, evidência esta que deve ser corroborada por outros experimentos. Variações em técnicas, métodos, animais experimentais, tipo de alojamento, entre vários outros fatores, todos resultam em acúmulo de evidência que permitem, no curso do tempo, confirmação ou descarte do fator ou efeito estudado.
2.3 Identificando a causa da doença
Após a caracterização da doença, precisamos caracterizar qual é sua causa. A correta identificação causal é preponderante para que possamos estabelecer um tratamento e estratégias de controle e prevenção de tal doença. Mas tal identificação causal em muitos casos não é tão simples nem tão direta como alguns desejariam. A Thomas Koch, um dos pesquisadores que ajudaram a estabelecer a Teoria da Higiene, é atribuido o conjunto de critérios para identificação da causa de doenças, os chamados “Postulados de Koch”. Tais postulados, os quais Koch nunca os proferiu explicitamente, podem variar em número e apresentação, e foram uma contrução coletiva da ciência da época (Gradmann 2014), na busca de uma delimitação de como estabelecer-se uma relação causal de um microorganismo com uma doença. O conjunto mais simplificado destes postulados, estabelece que, para uma bactéria ser considerada a causa de uma doença, ela deveria:
- Deveria ser isolada em cultura pura de todo animal com a doença estudada;
- Que ao inocular a bactéria obtida de um animal doente em um animal saudável, este deveria reproduzir os sinais clínicos da doença estudada;
- Que a bactéria deveria ser isolada em cultura pura deste animal inoculado;
Esta visão de determinação causal dominou a ciência por quase 100 anos, e ainda contamina o pensamento de muitos epidemiologistas, e é baseada numa visão simplista e mecanicista presa à “causa” da doença, como se ela realmenta fosse uma só. Entretanto, ela foi gradualmente sendo questionada e modificada no curso do aprendizado da ecologia, epidemiologia, parasitologia, microbiologia, entre outras áreas da ciência, neste período. Isto porquê para cada um dos postulados de Koch foram sendo caracterizados exemplos que contradiziam a visão estabelecida por estes pesquisadores do século XIX: que o parasito é causa única e exclusiva da doença. Nesta evolução os pesquisadores foram gradativamente caracterizando a importância fundamental da comunidade parasitária albergada pelo animal (tanto em número como diversidade) e do ambiente como fatores de modulação da saúde do animal que determinam, ajudam ou provocam a doença clínica que estivermos estudando. Ambiente, microbiota e hospedeiro definem juntos a ocorrência ou não da doença clínica, e a possibilidade deste arcabouço causal é acomodada perfeitamente perla filosofia da ciência deste século (Eberhardt 2009; Vandenbroucke, Broadbent, and Pearce 2016).
Assim, hoje compreendemos que qualquer organismo biológico é um ônibus parasitário. Carregamos conosco, seres vivos pluricelulares que somos nós os animais, uma miríade de microorganismos, uma microbiota que por si só constitui um ecossistema estabelecido dentro e sobre o animal (Sender, Fuchs, and Milo 2016). Tal microbiota, no curso evolutivo de milhões de anos, adaptou-se (e adapta-se constantemente) às condições e desafios impostos pelo hospedeiro, o qual possui mecanismos de identificação e controle desta microbiota. Esta adaptação deve ser vista como positiva (na maior parte das vezes) para hospedeiro e microbiota no curso evolutivo, afinal de contas foram favorecidas pela seleção natural tais relacionamentos intra- e inter- seres vivos. Entretanto, há uma competição constante por recursos que, em alguns casos, leva à morte (e até mesmo extinção) a hospedeiros ou ao parasito (ou componente de microbiota). Esta competição de microbiota e hospedeiro por recursos e reprodução foi interpretada pela ciência na forma da Teoria da Rainha Vermelha (“Red Queen Theory”; VanValen (1973)). Nesta analogia com o livro de Lewis Carrol “Alice através do espelho”, parasito e hospedeiro “correm” um contra o outro no tempo evolutivo para ficarem onde estão: convivendo e co-vivendo. Alguma vantagem evolutiva adquirida aleatoriamente no curso da evolução pelo parasito pode aumentar sua transmissibilidade e patogenicidade, acarretando doença e morte mais grave no hospedeiro. Este, por sua vez, submetido a tal pressão seletiva pode vir a adquirir mutação gênica que melhore sua resposta imune contra o parasito em questão, diminuindo a população deste gradualmente, por prejudicar sua reprodução. E assim, sucessivamente, parasito (microbiota em última instância) e hospedeiro competem um contra o outro em termos de sucesso reprodutivo, para manter-se onde estão: no ambiente e vivos. Embora esta Teoria tenha alguns concorrentes, considero que ainda seja a proposta mais adequada para o estado da arte atual (Solé 2022). Assim, para identificarmos a causa de uma doença nós precisamos ter em mente que muitas vezes não há uma só causa de uma doença, mas sim uma plétora de fatores que interrelacionados no tempo cronológico e no espaço geográfico acarretam um quadro mórbido no hospedeiro.
Nesta evolução de estabelecimento da causa das doenças, a apresentação de Sir Hill (A. B. Hill 1965) foi um marco por atribuir importância ao ambiente do organismo, extrapolando o limitado conceito dos postulados de Koch de um parasito-uma doença. Neste trabalho ele estabelecee vários critérios para que um determinado microorganismo ou fator de risco ser estabelecido como causa de alguma doença. De uma forma resumida, os critérios são os seguintes:
Força de Associação: A causa hipotética e a doença tem correlação com peso evidente?
Consistência de Apresentação: A doença e sua causa hipotética tem sinais e alterações clínicas consistentes em diferentes lugares, tempo cronológico e hospedeiros afetados?
Especificidade nos Critérios: A doença se apresenta dentro de determinados critérios específicos, sejam eles microorganismos, situações, ambientes, épocas, hospedeiros?
Temporalidade Correta: Efetivamente a causa precede o efeito?
Gradiente Biológico: Existem variações na doença atribuíveis a diferenças na dose infectante e no tempo de exposição?
Plausabilidade e Coerência: A patogenia proposta da causa hipotética sobre a doença é plausível como novidade, e faz sentido à vista do estado da arte da doença?
Evidência Experimental: Experimentos bem-estabelecidos suportam a afirmativa inequívoca da causa hipotética como efetiva causa da doença?
Analogia Pertinente: Existem paralelos úteis que possam ser estabelecidos com outros fenômenos biológicos ou relações parasito-hospedeiro similares?
Estes critérios foram revistos em Rothman and Greenland (2005), além de criticados e ampliados em algum aspecto. Vários dos itens acima podem ser deixados de lado no estabelecimento de causalidade de doença, e alguns podem não ser realizados por impossibilidade experimental, p. ex. Neste trabalho eles também analisam outras possibilidades de relacionamento causa-efeito, onde podem existir as chamadas “causas suficientes”: fatores que são suficientes para causar a doença. Em outros casos tais causas podem ser denominadas “necessárias”: na ausência destas a doença não ocorre. Mas o que parece mais apropriado é entender todas estas causas como componentes de um arcabouço de multi-relacionamentos causais, que se complementam, atenuam ou exacerbam entre si, resultando ou não na provocação da doença nos animais submetidos àquele conjunto de fatores (Rothman and Greenland 2005).
Este foi justamente o caso, da infecção por Trypanosoma cruzi em micos leões dourados e micos leões de cara dourada: ao término do estudo, cinco fatores diferentes, a espécie, sexo e idade do animal, co-infecções helmínticas e a fitofisionomia do local de origem influenciavam a prevalência e severidade da infecção pelo T. cruzi (Rafael V. Monteiro, Dietz, and Jansen 2010). Além de admitir a multi-causalidade como praticamente a norma, no que entende-se hoje por “teias causais”, eles também demonstram como interações entre os componentes desta teia de fatores que contribuem para a doença ocorrer é que irão determinar quem, onde e como os hospedeiros serão afetados pela doença em questão. O Médico Veterinário do século XXI deve estar em atenção a estas teias causais quando do estudo epizootiológico moderno, ou mesmo quando do atendimento clínico a animais pet tutoriados domesticamente: as mesmas teias causais de doença estarão afetando a saúde deste animal (Shimonovich et al. 2021).
Baseado nos critérios acima descritos, quando estamos dentro de uma investigação epizootiológica nós costumamos utilizar alguma das abordagens metodológicas abaixo, para tentar esclarecer qual ou quais são os fatores causais que devem ser considerados no momento.
Método da Concordância: Tendo em vista a diversidade de situações, locais, hospedeiros e microorganismos candidatos a fatores causais da doença em análise, os que estão presentes em todas as situações podem ter alguma participação causal.
Método da Diferença: Tendo em vista as diferenças existentes entre animais doentes e não doentes, os fatores e microorganismos que estão apenas entre os doentes tem maior chance de serem causa da doença.
Método da Variação Concomitante: Quando doença e determinados fatores e microorganismos flutuarem no tempo cronológico concomitantemente, é possível que estes sejam causa da doença.
Método dos Resíduos: Parafraseando o Sherlock Holmes de Sir Conan Doyle (A. B. Hill 1965) ‘when you have eliminated the impossible, whatever remains, however improbable, must be the truth.’ (“quando você eliminou o impossível, o que sobrar, não importa o quão improvável, deve ser a verdade”). O mesmo raciocínio aplica-se aos fatores causais: se você eliminou todas as outras possibilidades causais, o que restar deve ser a causa da doença.
Método da Analogia: Procura-se outros exemplos de doenças similares à investigada, as quais possam servir de paralelo para elucidar a causa da doença atual.
Estas abordagens metodológicas podem ser utilizadas junta ou separadamente. É comum durante o trabalho epizootiológico que o investigador lançe mão de um pout-pourri delas, já que elas podem ser complementares entre si. Em determinadas situações elas podem ser utilizadas sequencialmente: analisa-se os animais doentes, comparamos com os saudáveis, acompanhamos no curso do tempo, eliminamos possibilidades e comparamos com outras situações semelhantes. O que deve estar claro para o pesquisador é que, na boa ciência, um trabalho não prova nada, é o acúmulo de informações concordantes que adiciona peso e credibilidade à sugestão feita por algum ou alguns pesquisadores acerca da etiologia de determinada doença. É importante que haja corroboração estatística e pelos pares da ciência para que fatores candidatos possam ser efetivamente considerados causais (A. B. Hill 1965; Rothman and Greenland 2005; Vandenbroucke, Broadbent, and Pearce 2016; Shimonovich et al. 2021). Abaixo veremos como a ciência trata este acúmulo de informações.
2.4 Demonstração científica da causa da doença
Na construção deste corpo de indícios e evidências acima descrito, necessário para estabelecermos não só a causa de uma determinada doença, mas da mesma forma a existência de efeito terapêutico de determinada droga ou eficácia de técnica médica-veterinária, foi sendo estabelecida pela comunidade científica um consenso sobre uma hierarquia de qualidade da evidência apresentada. O estabelecimento desta hierarquia leva em consideração o tipo e forma da publicação científica que divulga o corpo dos resultados de tais indícios e evidências, os quais podem variar de simples opiniões em editoriais a robustas revisões das publicações que versam sobre um determinado assunto. Um aspecto importante é que frente ao tremendo crescimento em produção científica durante o final do Século XX e este início de XXI, a quantidade de publicações científicas também aumentou tremendamente. Este aumento em quantidade não foi acompanhado em qualidade de todas elas, devido a fatores que variam desde a competição entre publicações, concorrências internacionais, falhas na revisão feita pelos pares, ausência de revisão pelos pares, até mesmo à fraude pura e simples. Uma forma de nivelar as publicações pela qualidade veio na forma da criação de índices, como o fator de impacto (“impact factor”), entre outros, os quais visam detectar bons pesquisadores e revistas com base no alcance e influência que o estes tem sobre os outros pesquisadores.
No caso da forma da publicação científica a menor força de evidência científica epizootiológica está nos editoriais e artigos de opinião em revistas científicas ou mesmo de divulgação científica (Guyatt et al. 2006). Isto porquê são evidências baseadas em dados preliminares, incompletos, extrapolativos ou mesmo controversos. Entretanto, estes podem vir a ser o ponto de partida para muitas linhas de investigação, as quais podem corroborar ou refutar a opinião emitida na publicação apresentada. A partir deste momento da pesquisa ou da investigação do fenômeno, os resultados de estudos epidemiológicos já devem ser oriundos de desenhos de estudo epidemiológico específicos, apropriados para a investigação mais aprofundada da pergunta epidemiológico em questão. Tais desenhos são abordados mais aprofundadamente no Capítulo 8, mas apresento abaixo um resumo dos principais.
Para gerar ou aprofundar indícios epidemiológicos são apropriados os estudos Observacionais que, como o nome indica, apenas observam. Como estes relatam apenas o que foi observado em natureza, tendem a sofrer com muita influência dos fatores ambientais, mas podem indicar determinadas condições ambientais associadas à existência da morbidade, como hospedeiros, sexos e/ou idades mais ou menos prejudicados. Já a seguir os estudos Transversais, já são capazes de demonstrar correlação, ou força de associação, entre uma determinado agente etiológico candidato e seu efeito mórbido. Em outras palavras, nos indivíduos da população analisada você encontrará o sinal clínico ou alteração laboratorial frequentemente associado ao agente etiológico candidato. Até este momento estamos estabelecendo indícios de associação causal entre um parasito e a doença em questão, ainda insuficientes para justificar qualquer intervenção ou aceitação da hipótese (Grimes and Schulz 2002). Neste ponto da pesquisa para estabelecimento da causa de uma determinada doença (principalmente as emergentes, pela novidade que apresentam), tal associação entre causa putativa e efeito clínico-laboratorial deve ser corroborada, se verdadeira, em locais, tempo cronológico e, eventualmente, espécies animais diferentes, através da pesquisa científica sobre a matéria. Destarte, este tipo de estudo é inadequado para que algum pesquisador estabeleça um relação de causalidade entre causa-efeito, ou seja ligação inequívoca entre causa putativa e efeito mórbido. Falta a estes tipos de estudo a sequência no tempo entre causa e efeito: a causa hipotética deve infectar ou agir no animal ANTES dos efeitos começarem a aparecer.
Os dados obtidos a partir de todos estes estudos acima suportarão então a realização dos tipos de estudo que são capazes de estabelecer de forma inequívoca a associação entre uma causa putativa e seu efeito patogênico: os estudos de Coorte e de Caso-Controle. A partir deste momento já estamos acumulando evidências de associação causal, que já justificam algum tipo de intervenção (Grimes and Schulz 2002). Em linhas gerais, estes tipos de estudos acompanham os animais no curso do tempo, individualmente, e são capazes de estabelecer que determinado efeito mórbido sobre o animal começa a se instalar APÓS o contato ou infecção com a causa putativa. Novamente, se verdadeira é a associação causa-efeito, outros estudos comprovarão tal ligação. Nossa causa hipotética (putativa) pode agora denominar-se agente etiológico de tal doença.
Neste momento os pesquisadores podem realizar os estudos Experimentais. Como o nome indica, nesta fase terminal da atribuição etiológica a uma doença, o pesquisador pode remover ruídos ambientais e genéticos, tanto de hospedeiro como de agente etiológico, de forma a estabelecer patogenia, diferenças entre os sexos, modulações produzidas por co-infecções, enfim, parâmetros e variáveis de interesse que possam elucidar aspectos ainda obscuros da relação parasito-hospedeiro. Estes estudos podem ser realizados de forma não-controlada ou controlada (com controle ou não das condições de experimentação, muitas vezes em laboratório), sendo denominados respectivamente Testes Não-Controlados ou Testes Controlados. Testes controlados são mais confiáveis por reduzirem ou eliminarem o ruído ambiental das condições de experimentação. Estes tipos de estudo podem ser realizados com ou sem aleatorização nos sujeitos de estudo e na atribuição dos animais aos grupos experimentais. Quando não houver aleatorização os estudos são denominados Testes Controlados não-aleatorizados. Em contraste, quando houver aleatorização eles serão Testes Controlados Aleatorizados, que são os que carregam o maior peso de evidência experimental, justificando intervenções baseadas no seus resultados (Grimes and Schulz 2002).
Variações nos parâmetros dos estudos iniciais, que pareçam ser relevantes para a ligação causa-efeito em questão, podem e devem ser introduzidas. Este tipo de pesquisa científica mais elaborada geralmente tem lugar em laboratórios, sob condições controladas, onde podemos remover as fontes de variação que possam levar à erros de tipo II. Por exemplo, utilizando-se no experimento animais de mesma raça, sexo, idade e peso, removemos dos dados todo o ruído que tais fatores introduziriam na análise. Por outro lado, todos estes fatores não farão parte da nossa comparação e não serão avaliados, devendo ser introduzidos gradualmente em outros trabalhos e pesquisas científicas para serem levados em conta.
É recomendável também que eliminemos o efeito humano da análise. Para isso os Testes Controlados Aleatorizados podem ser feitos com análise no estilo Cego ou Duplo Cego. No primeiro caso do teste Cego quem faz a intervenção no animal não tem conhecimento de que fator está modificando. Ele não sabe o que está aplicando no animal, ou não sabe se a ausculta que ele faz é em um cardiopata ou não. Já no caso da análise em Duplo Cego tanto quem intervém no animal quanto quem analisa o material desconhecem a origem do material. Assim, o desenho experimental mais refinado utilizado para atribuição de causa-efeito na ciência Veterinária é o Teste Controlado Aleatorizado Duplo Cego.
Por último, e levados em alta conta na comunidade científica por seu peso como evidência (Gopalakrishnan and Ganeshkumar 2013), encontram-se os estudos chamados de Revisão Sistemática com Meta-Análise. Estes trabalhos dedicam-se a revisar todo o corpo de evidência que se encaixe nos critérios estabelecidos pelos pesquisadores. Estes critérios para incluir ou não um determinado artigo científico na meta-análise distribuem-se entre parâmetros como técnica utilizada, número de animais experimentais, tempo de publicação, local de realização entre outros, em suma, critérios que geram variação na gama de resultados apresentados por cada um deles, mas que permitem que seus resultados sejam comparados entre si. O resultado de uma Meta-análise sistemática leva então em consideração a proporção de trabalhos sobre o assunto que concordam ou discordam entre si, gerando um painel sobre a relação parasito-hospedeiro (ou efeito terapêutico de droga, técnica cirúrgica ou mesmo abordagem diagnóstica) que é uma expressão o melhor construída possível da ação da causa sobre os animais e os efeitos mórbidos associados. Dependendo do tipo de área da Epidemiologia várias meta-revisões podem ser produzidas, com critérios de inclusão/exclusão diferentes. O que se espera, caso a causa da doença tenha sido corretamente identificada, é que a grande maioria dos trabalhos concordem com tal associação e seus efeitos sobre a saúde e bem-estar dos animais.
References
‘Qualquer prejuízo que interfira com ou modifique o desempenho das funções normais, incluindo respostas a fatores ambientais como nutrição, toxinas, e clima; agentes infecciosos; defeitos congênitos ou inerentes, ou a combinação destes fatores.’↩︎