第2章 它绝非仅是组织活检的替代品
第2期,我们将对液体活检的优势进行介绍,期望能使您认识到液体活检的重要意义,它绝非仅仅是无法进行组织活检时的替代选择。
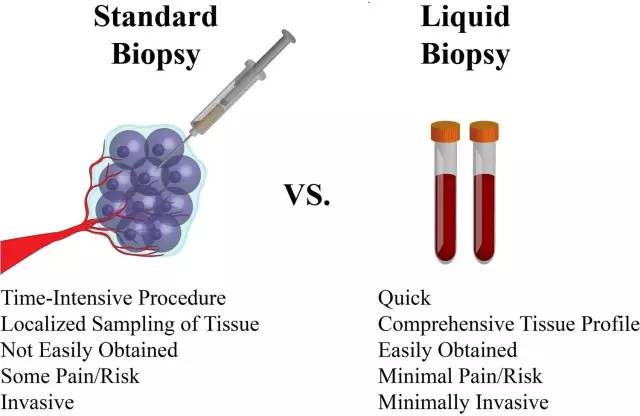
Figure 2.1: 液体活检不仅省时、易得、将痛苦和风险降至最低,更重要的是它能全面地反映肿瘤的状况,这是组织活检无法做到的。
2.1 无创
液体活检最显而易见的优势,就是无创。组织活检对于一些不适合手术的患者,就需要进行穿刺活检。然而存在肿瘤的位置较为特殊不适合穿刺,或者患者对于穿刺不耐受的情况,而且更严重的是,穿刺会对肿瘤进一步刺激,容易激发癌细胞的快速增长或诱发转移。这些情况下,液体活检是组织活检的替代方案,然而,液体活检的优势绝不仅仅是这一点而已哦。
Figure 2.2: 人类心脏与肺之解剖。当肺部肿瘤生长在靠近心脏的位置时,进行穿刺活检有较大风险,此时可选择以液体活检代替。
2.2 临床手段无法检测到肿瘤组织的情况
组织活检主要依赖于影像学检查,然而当肿瘤刚刚发生或治疗后存在残留等情况时,影像学往往难以发现端倪。而血液中却可能存在一些蛛丝马迹,例如肿瘤细胞释放的DNA片段或外泌体等,从而实现肿瘤早期筛查以及术后的复发风险预测等。
早期筛查,是针对健康人群,通过液体活检标志物来预测肿瘤的发生,做到肿瘤的早发现早治疗。目前重点研发的标志物包括ctDNA突变模型、ctDNA甲基化、cfRNA、外泌体等。不过,液体活检进行肿瘤早筛技术上还不成熟,主要原因是早期肿瘤释放的标志物极少,检出率很低,其应用还需要一定的技术突破才能实现了。
2.3 实时反映病情变化
也许有人会有疑问,液体活检标志物会不会像抗体一样能够长期存在?是否会出现肿瘤治愈数年后依然能够检测到肿瘤释放的DNA等物质的情况,导致不能反映肿瘤实时的情况呢?
事实上,液体活检标志物的半衰期很短,例如有研究表明ctDNA的半衰期不足2小时,这使得其可以精确反映肿瘤实时信息,达到指导用药、疗效和耐药监测等目的。
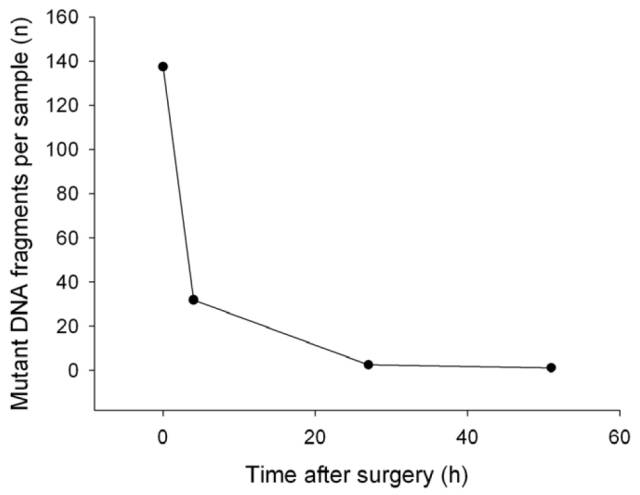
Figure 2.3: 术后不到30小时,ctDNA便无法检测到了。半衰期短的特点使得ctDNA反映的都是最实时的状况。
2.4 实现动态监测
液体活检由于其灵活无创的特点,可以实现对于复发、疗效或耐药的动态监测。影像学的提示往往会滞后,并且仅能显示肿瘤形态的变化,对于肿瘤内部如不同亚克隆间的消长无法分析,而且频繁的检测也有辐射带来的危害。
液体活检往往能够更早提示肿瘤的变化,而且能够提示更为丰富的信息,提前预知复发,根据基因信息动态分析敏感和耐药克隆的变化,及时提示改变用药方案。有研究表明,ctDNA等标志物能够比影像学和CEA等蛋白标志物更准确地反映肿瘤的情况。例如Dawson SJ等就在乳腺癌病人中发现,CTC和ctDNA比蛋白标志物更加灵敏。
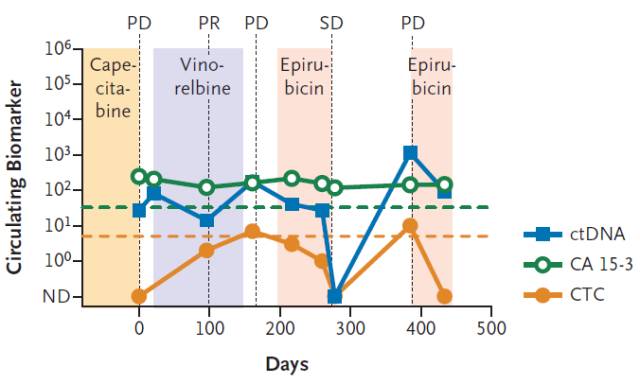
Figure 2.4: 相比于传统的蛋白标志物CA15-3,ctDNA和CTC的变化更加灵敏。
2.5 克服肿瘤异质性
肿瘤在生长过程中,经过多次分裂增殖,其子细胞呈现出分子生物学或基因方面的改变,从而使肿瘤内出现不同的亚克隆,亚克隆间生长速度、侵袭能力、对药物的敏感性、预后等各方面都存在差异。而对于癌细胞已经发生转移的患者而言,不同病灶间的差异会更加明显。
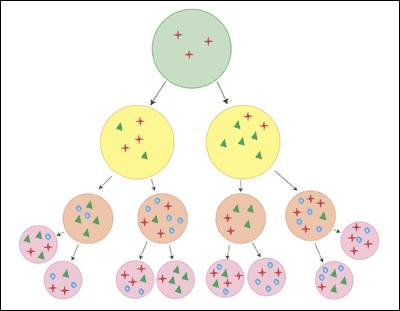
Figure 2.5: 肿瘤的异质性。我们必须认识到,肿瘤组织并不是单纯、均一的。如同一个社会中存在各式各样的人,肿瘤组织中也存在各式各样的亚克隆。
这种异质性会导致组织活检出现假阴性,而血液是全身循环的,能够更全面地获取肿瘤信息。如果检测技术灵敏度足够高,液体活检能够达到比组织更高的敏感性,例如Lanman RB等就通过上千例样本检测发现,ctDNA检测敏感性85.0%,高于组织活检的80.7%。如果结合组织活检和液体活检,则可进一步提高阳性率,使更多患者获益。
所以:
液体活检绝不仅仅是组织活检无法进行时的替代品,而是能够将基因检测引入肿瘤早期筛查和动态监测的革命性技术!在指导个体化用药方面液体活检也能以其全面、灵活和无创的特点,成为组织活检的良好补充。
参考文献
- Dawson SJ1, Tsui DW, Murtaza M, et al. Analysis of circulating tumor DNA to monitor metastatic breast cancer. N Engl J Med. 2013 Mar 28;368(13):1199-209.
- Diehl F, Schmidt K, Choti MA, et al. Circulating mutant DNA to assess tumor dynamics. Nature medicine. 2008;14(9):985-990.
- Lanman RB, Mortimer SA, Zill OA, et al. Analytical and Clinical Validation of a Digital Sequencing Panel for Quantitative, Highly Accurate Evaluation of Cell-Free Circulating Tumor DNA. Hoheisel JD, ed. PLoS ONE. 2015;10(10):e0140712