第6章 ctDNA的四大应用
第6期,我们将对ctDNA的应用进行介绍,期望使您掌握目前ctDNA在各方面应用的理论基础和进展情况。
ctDNA检测由于实时、无创、灵活等特点,可以应用于肿瘤的各阶段,解决不同的问题,从早期筛查、辅助诊断、预后判断、到靶向用药指导、疗效及耐药监测等。
由于ctDNA含量与肿瘤负荷、肿瘤分期、转移等密切相关,所以目前晚期肿瘤的用药及监测等应用相对更加成熟;而对于早期肿瘤的筛查与诊断,技术上难度更高,整体上仍处于科研阶段。
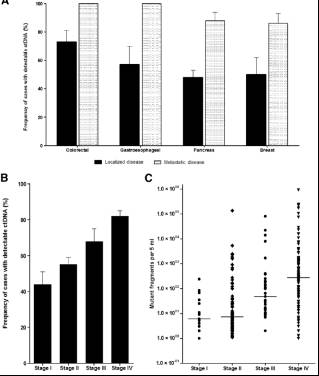
Figure 6.1: ctDNA含量在转移癌和原位癌、不同分期间的差异。
6.1 靶向用药指导
在靶向用药指导上,可以说ctDNA已经确立了江湖地位了。一方面,样本易获取,在组织样本无法获得时可以作为替代品;而另一方面,ctDNA的全面性也可以避免很多肿瘤异质性带来的假阳性。
以Guardant Health的数据为例,我们可以看出,组织和血液互为参照的话,假阳性率都很低,但都存在一定假阴性,血液的敏感性甚至高于组织!也就是说,血液检测的结果绝不只是组织的替代品,而是一个有效的补充。如果血液和组织同时检测,能够进一步提高检出率,使更多患者受益。

Figure 6.2: cfDNA与组织检测同时进行,可使诊断准确率上升。
另外,组织和血液的阳性结果,对于用药来说,意义是等同的。例如,在AZD9291的临床试验中,组织和血液阳性样本对药物的反应率一致,单样本阳性和双样本阳性的患者生存获益没有差异。
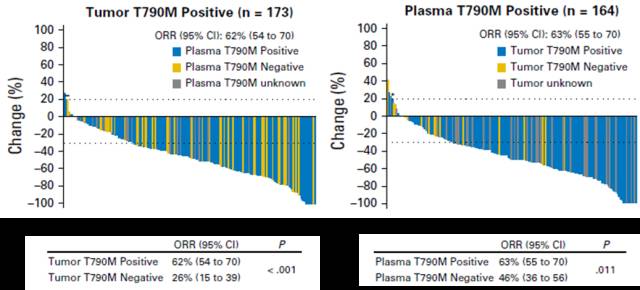
Figure 6.3: 左为组织,右为血液。
6.2 动态监测
ctDNA中肿瘤相关的突变频率,会随着肿瘤的进展和治疗而动态变化,因此监测这些突变频率的变化过程,可以指示治疗的疗效、耐药以及肿瘤复发等。
早在2008年,Diehl F.等就发现,APC、KRAS、TP53、PIK3CA等基因热点突变的频率会随着治疗过程变化,变化趋势与肿瘤负荷呈正相关。
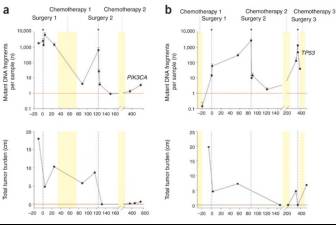
Figure 6.4: ctDNA可以作为动态监测的工具。
同样,ctDNA突变频率的变化也可以指示复发,例如Reinert T.等人通过ctDNA的监测与CT和蛋白标志物的对比,发现在部分病例中,ctDNA频率的升高,要早于影像学和蛋白标志物的变化,以便于尽快采取治疗措施。
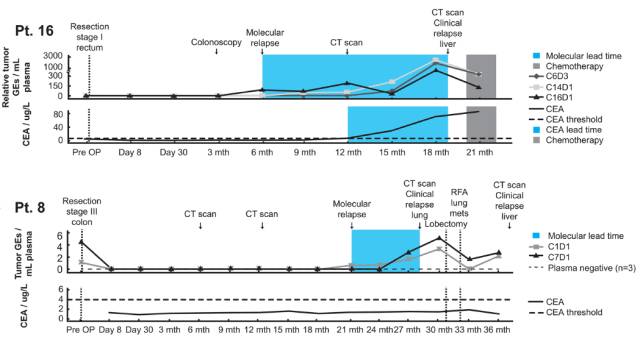
Figure 6.5: ctDNA是更为灵敏的蛋白标志物。
6.3 预后判断
术后ctDNA的检出情况可以提示预后,利用ctDNA特征突变是否检出、突变频率值或术前术后突变频率的变化,均可以作为预后的判断指标。
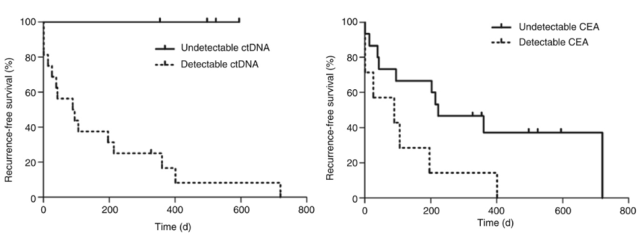
Figure 6.6: 利用ctDNA是否检出对复发风险的判断要优于CEA。
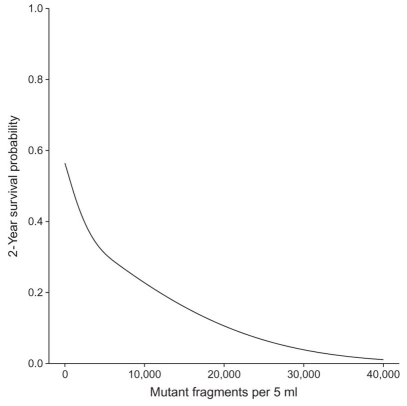
Figure 6.7: ctDNA突变频率与生存率负相关。
6.4 早期筛查与诊断
由于ctDNA释放较少,肿瘤早期的筛查与诊断的难度更高。另外,肿瘤的个体差异导致,难以用少数几个基因状态来衡量所有人,必须需要上百甚至上千个肿瘤相关基因,来建立一个复杂的模型,通过对突变、甲基化等情况的分析来综合考量。
目前,尚没有见到前瞻性研究的成果,不过,已有一些回顾性的研究预示着这种应用的可行性。海普洛斯通过数十例的前期样本,通过ctDNA上百个基因突变的模型,判断肺结节良恶性,并区分病理类型,达到了70%以上的敏感性和特异性;另外,ctDNA甲基化也可用来进行肿瘤诊断和组织溯源。例如,卢煜明教授团队发现,利用ctDNA低甲基化来判断肝癌,可以达到74%的敏感性和94%的特异性;2015年,他们又发文章表示,ctDNA甲基化模式可以区分组织来源。
相信随着研究规模的扩大,大数据与机器学习等手段的运用,利用ctDNA进行肿瘤筛查和诊断也将逐渐成为可能!
参考文献
- Bettegowda C, et al. Detection of Circulating Tumor DNA in Early- and Late-Stage Human Malignancies. Sci Transl Med. 2014 Feb 19;6(224):224ra24.
- Lanman RB, et al. Analytical and Clinical Validation of a Digital Sequencing Panel for Quantitative, Highly Accurate Evaluation of Cell-Free Circulating Tumor DNA. PLoS ONE 10(10):e0140712.
- Oxnard GR, et al. Association Between Plasma Genotyping and Outcomes of Treatment With Osimertinib (AZD9291) in Advanced Non-Small-Cell Lung Cancer. J Clin Oncol. 2016 Oct 1;34(28):3375-82.
- Diehl F, et al. Circulating mutant DNA to assess tumor dynamics. Nat. Med. 14, 985–990 (2008).
- Reinert T, et al. Analysis of circulating tumour DNA to monitor disease burden following colorectal cancer surgery. Gut 2015;0:1–10.
- Chan KC, et al. Noninvasive detection of cancer-associated genome-wide hypomethylation and copy number aberrations by plasma DNA bisulfite sequencing. Proc Natl Acad Sci U S A. 2013 Nov 19;110(47):18761-8.
- Sun K, et al. Plasma DNA tissue mapping by genome-wide methylation sequencing for noninvasive prenatal, cancer, and transplantation assessments. Proc Natl Acad Sci U S A. 2015;112(40):E5503-E5512.