4 Morfología evolutiva
4.1 ¿Son todas las morfologías posibles en evolución?
4.1.1 Adaptación vs Restricción
Existen dos posturas principales para explicar la presencia de espacios vacíos en el morfoespacio (morfologías no exploradas por la evolución) (Fig. 4.1): la perspectiva de la adaptación (externalista) y la perspectiva de las restricciones del desarrollo (internalista). Desde una perspectiva de la adaptación, se infiere que los espacios no ocupados en el morfoespacio están vacíos porque tienen baja aptitud y son seleccionados en contra. Estas inferencias dependen de suposiciones aventuradas, ya que la ausencia de ciertas morfologías se explica por baja aptitud y la baja aptitud se infiere a partir de esta ausencia. Por otro lado, está quien defiende que factores no adaptativos, como las restricciones del desarrollo (constraints), también podrían explicar plausiblemente la existencia de una parte del morfoespacio vacía. En respuesta, los (paleo)biólogos estudian cada vez más la ontogenia para probar la suposición de que los fenotipos no observados podrían producirse si la selección los favoreciera; encontrar que las morfologías de espacios vacíos pueden producirse fácilmente en el desarrollo ayuda a rechazar la restricción y respalda las hipótesis adaptativas. Este enfoque del desarrollo para la adaptación recurre a una variedad de técnicas, incluidas la embriología, la selección artificial y los métodos comparativos. A pesar de su diversidad, todos estos métodos examinan las causas del morfoespacio vacío y marcan el regreso del desarrollo, que durante mucho tiempo estuvo excluido de la biología evolutiva tradicional, a la práctica adaptacionista.
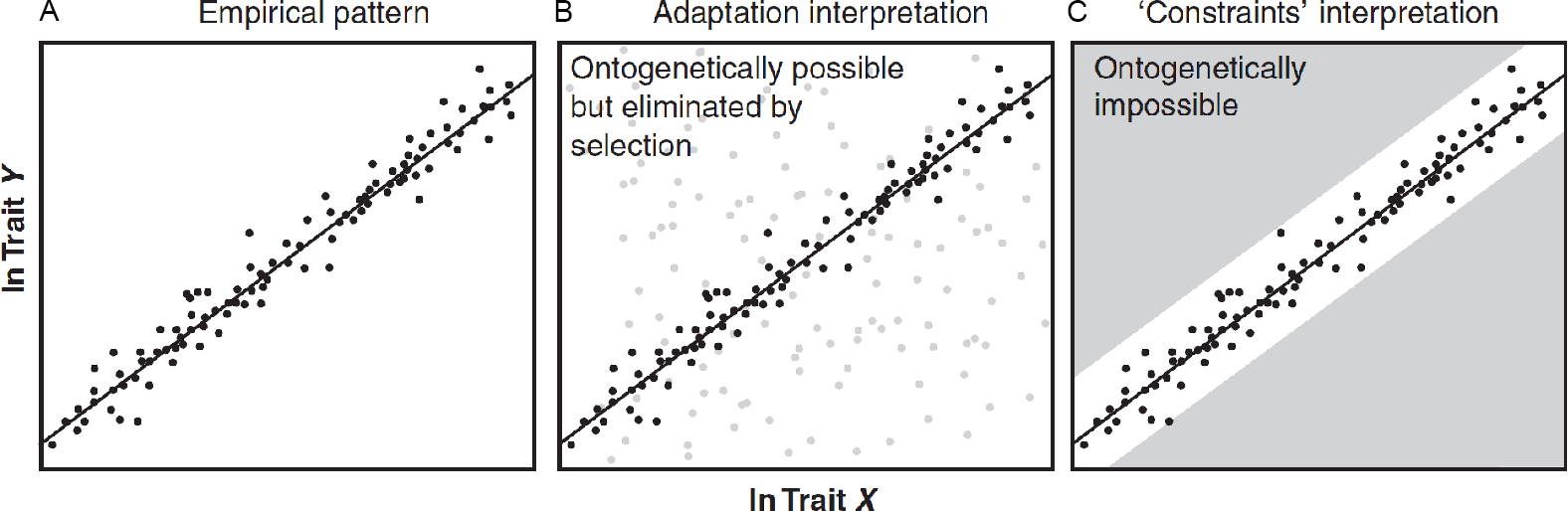
Figura 4.1: Explicaciones de “adaptación” y de “restricciones” para los mismos datos, y el terreno común de la ontogenia. (A) Los datos empíricos presentan un patrón que debe explicarse, una llamativa corelación y espacios conspicuos vacíos. Los puntos negros representan los datos observados, que podrían ser individuos dentro de una especie o incluso valores promedio de especies; la línea es un ajuste de regresión. (B) Desde el punto de vista de la adaptación, se asume que una relación de escalamiento alométrico entre dos rasgos corresponde a las combinaciones de rasgos de mayor aptitud. Se asume que las áreas vacías son ontogenéticamente accesibles (posibles), pero si se produjeran (puntos grises), tendrían una aptitud menor que las observadas. (C) En cambio, desde una perspectiva de restricciones, los mismos datos se interpretarían como áreas de difícil o imposible acceso durante el desarrollo (campos grises). Sin estudios sobre el potencial de desarrollo, es imposible distinguir entre estas posturas. Imagen tomada de Olson (2012).
4.1.2 Los spandrels de San Marco y el paradigma panglosiano
Desde mediados del siglo XX, un programa adaptacionista dominó el pensamiento evolutivo en Inglaterra y Estados Unidos. Se basaba en la fe en el poder de la selección natural como agente optimizador. Este enfoque consistía en descomponer un organismo en ‘rasgos’ unitarios y proponer una historia adaptativa para cada uno considerado por separado. Los compromisos entre las demandas selectivas en competencia serían el único freno a la perfección; así, la no-optimalidad se presentaría también como resultado de la adaptación.
Un artículo clásico de Stephen Jay Gould y Richard Lewontin publicado en 1979 supone un punto de inflexión en este sentido, donde realizan una crítica demoledora a este enfoque. En este trabajo proponen una alternativa de estudio de la adaptación (largamente popular en Europa continental) donde los organismos son analizados como totalidades integradas, con planes de organización tan condicionados por la herencia filogenética, el desarrollo y la arquitectura general que las propias restricciones se vuelven más interesantes y más importantes a la hora de delimitar los caminos de cambio morfológico que la propia fuerza de la selección natural. La crítica al programa adaptacionista se basa en varios puntos clave. Primero, este enfoque no logra diferenciar entre la utilidad actual de las estructuras y las razones por las que surgieron. Por ejemplo, aunque los machos de tiranosaurio pudieron haber utilizado sus pequeñas patas delanteras durante la cópula, esto no explica por qué esas patas se volvieron tan pequeñas en primer lugar. En segundo lugar, el programa adaptacionista muestra una renuencia a considerar otras explicaciones diferentes a las historias adaptativas. Además, se apoya únicamente en la plausibilidad para aceptar narrativas especulativas, sin un análisis más riguroso. También omite temas importantes que podrían competir con su visión, como la fijación aleatoria de alelos y la creación de estructuras no adaptativas que pueden surgir a través de correlaciones de desarrollo con características seleccionadas, como la alometría y la pleiotropía. Además, no considera adecuadamente la posibilidad de que la adaptación y la selección sean procesos separables, la existencia de múltiples picos adaptativos y que la utilidad actual de una estructura puede ser solo un efecto secundario de una estructura no adaptativa.
Para ilustrar esta perspectiva Gould y Lewontin se apoyan en una analogía arquitectónica de la catedral de San Marcos de Venecia, donde los espacios proyectados por el arquitecto, que surgen como “subproducto” inevitable al montar una cúpula sobre arcos de medio punto, se prestan a ser decorados con frescos (Fig. 4.2):
“The great central dome of St Mark’s Cathedral in Venice presents in its mosaic design a detailed iconography expressing the main stays of Christian faith. Three circles of figures radiate out from a central image of Christ: angels, disciples, and virtues. Each circle is divided into quadrants, even though the dome itself is radially symmetrical in structure. Each quadrant meets one of the four spandrels in the arches below the dome. Spandrels - the tapering triangular spaces formed by the intersection of two rounded arches at right angles - are necessary architectural by-products of mounting a dome on rounded arches. Each spandrel contains a design admirably fitted into its tapering space. An evangelist sits in the upper part flanked by the heavenly cities. Below, a man representing one of the four Biblical rivers (Tigris, Euphrates, Indus and Nile) pours water from a pitcher into the narrowing space below his feet.The design is so elaborate, harmonious and purposeful that we are tempted to view it as the starting point of any analysis, as the cause in some sense of the surrounding architecture. But this would invert the proper path of analysis. The system begins with an architectural constraint: the necessary four spandrels and their tapering triangular form. They provide a space in which the mosaicists worked; they set the quadripartite symmetry of the dome above. Such architectural constraints abound and we find them easy to understand because we do not impose our biological biases upon them”.

Figura 4.2: Uno de los cuatro spandrels de la catedral de San Marcos; evangelista sentado arriba, personificación del río abajo. Imagen tomada de Gould & Lewontin (1979).
El término “paradigma panglosiano” proviene del personaje Pangloss de la novela “Cándido” de Voltaire. Pangloss es un filósofo optimista que sostiene que “todo lo que sucede es para mejor en el mejor de los mundos posibles”, independientemente de las circunstancias adversas. En un fragmento de la novela, Pangloss narra: “Las cosas no pueden ser diferentes a como son… Todo está hecho para el mejor propósito. Nuestras narices fueron hechas para llevar gafas, así que tenemos gafas. Las piernas, claramente, estaban destinadas para los pantalones, y por eso los usamos.”. Según Gould y Lewontin, los biólogos evolutivos de la época, en su tendencia a centrarse exclusivamente en la adaptación inmediata a las condiciones locales, tendían de la misma manera a ignorar las restricciones arquitectónicas y a realizar esa misma inversión de la explicación.
Lectura recomendada
Gould, S. J., & Lewontin, R. C. (1979). The spandrels of San Marco and the Panglossian paradigm. Proc. R. Soc, Lond. B, 205, 581-598.
Olson, M. E. (2012). The developmental renaissance in adaptationism. Trends in Ecology & Evolution, 27(5), 278-287.
4.1.3 Seilacher, Konstruktions-Morphologie, morfodinámica y la evolución de la forma
4.1.3.1 Contexto histórico
La tradición morfológica alemana hizo una contribución importante al estudio de la forma en el siglo XX. Varios científicos allanaron el camino para esta investigación: el paleontólogo Adolf Seilacher, el entomólogo Hermann Weber y el biólogo Johann-Gerhard Helmcke, junto con el arquitecto Frei Otto. Todos ellos buscaban examinar los procesos morfogenéticos para ilustrar sus propiedades estructurales inherentes, desafiando así el programa adaptacionista de la teoría evolutiva. El desafío teórico alemán al pensamiento adaptacionista fue posible gracias a un intercambio y transferencia de prácticas, datos, tecnologías y conocimientos entre estudiantes de forma orientados biológicamente y arquitectos, diseñadores e ingenieros. Este intercambio de prácticas y conocimientos fue facilitado por el establecimiento de dos centros de investigación colaborativa a principios de la década de 1970.
Nacido cerca de Stuttgart, Alemania, Adolf Seilacher (1925–2014) (Fig. 4.3) desarrolló su interés en la paleontología al coleccionar fósiles locales de niño. Sirvió en la marina alemana antes de ingresar a la Universidad de Tübingen, donde completó su doctorado en 1951 y su Habilitación en 1957. Trabajó en las universidades de Frankfurt, Bagdad y Göttingen, y regresó a Tübingen como profesor en 1964. También fue profesor adjunto en la Universidad de Yale desde 1987 hasta 2009. Sus ideas sobre la morfología fósil fueron innovadoras, y sus métodos eran sencillos; era un gran observador, tanto en el campo como de ejemplares en museos, utilizando colecciones de instituciones para su investigación. Basaba sus interpretaciones en sus propios dibujos y los transformaba en diagramas reconocibles que ilustraban sus conferencias, artículos y libros.
Conocido como Dolf entre sus amigos y colaboradores, fue un paleontólogo célebre por hacer suyo el concepto de Konstruktions-Morphologie (morfología constructiva) para obtener conocimientos sobre la naturaleza y evolución de la forma, especialmente de organismos fósiles, reconociendo que la morfología de los organismos no es simplemente una respuesta adaptativa a la presión de selección, sino que también incorpora influencias filogenéticas y estructurales. Estuvo particularmente interesado en el “ruido de fabricación”, características no adaptativas que son consecuencia de los materiales disponibles y de los modos de crecimiento. Realizó importantes contribuciones a diversas áreas de la paleontología, revolucionando el análisis de los fósiles de trazas, que ofrecen información fundamental sobre el comportamiento y la ecología de organismos antiguos. También inició el estudio sistemático de sitios de excepcional preservación, que él llamó Fossil-Lagerstätten, notando que eran más que curiosidades paleontológicas, ya que proporcionan el único registro directo de la existencia de la mayoría de los animales marinos, que son blandos y normalmente se pierden por descomposición. Sus interpretaciones se basaron en el estudio detallado de muchos ejemplares, y a lo largo de una larga carrera internacional investigó ejemplos de casi todos los grupos de fósiles invertebrados, lo que resultó en su libro de 2015, Morphodynamics, una recopilación de sus observaciones y dibujos icónicos que se publicó después de su muerte.
El concepto de Konstruktions-Morphologie (morfología constructiva) se originó en la década de 1950 con el entomólogo alemán Hermann Weber. Weber fue profesor y director del Instituto Zoológico en la Universidad de Tübingen desde 1951 hasta su muerte en 1956. Su concepto reflejaba la idea de que la morfología sistemática, al carecer de una interpretación funcional, no contribuía a los estudios evolutivos. Consideraba a los organismos como puntos en una línea evolutiva, donde su morfología estaba determinada por su ascendencia, pero adaptada a la vida en un entorno particular. Durante este tiempo, Adolf Seilacher era asistente en el Instituto de Geología y Paleontología de Tübingen y asistió al curso de Weber sobre la terminología y el método de la Konstruktions-Morphologie.
Cuando Seilacher anunció en 1970 la inclusión de la Konstruktions-Morphologie en un proyecto sobre paleoecología que lideraba, destacó que este concepto ya se había aplicado en zoología durante muchos años. Su introducción a la paleontología fue oportuna, ya que coincidió con el surgimiento de nuevos enfoques para el análisis de la forma, particularmente la morfología teórica. La Konstruktions-Morphologie de Seilacher pronto llamó la atención de investigadores de habla inglesa, especialmente a través de David Raup, quien la hizo el tema central de un capítulo en un influyente volumen sobre paleobiología.
Aunque la Konstruktions-Morphologie de Weber había tenido poco impacto fuera de Alemania, las influencias que reconocía en la morfología eran ampliamente reconocidas. El análisis de la función en organismos vivos se basaba en una diversidad de enfoques, como la disección y la observación, mientras que el análisis de fósiles dependía de inferencias basadas en partes del organismo que se conservaban, como el esqueleto biomineralizado. En la década de 1960, las interpretaciones de la función en fósiles y su contribución al modo de vida del organismo se basaban en gran medida en comparaciones con formas vivas estrechamente relacionadas o con morfologías convergentes en la fauna actual. Un avance significativo en la interpretación de morfologías desconocidas y extintas fue el método de paradigma desarrollado por Martin Rudwick, que requería identificar diferentes posibles funciones y su correspondiente morfología.
Sin embargo, el método de paradigma presentaba dificultades cuando la morfología de un organismo era el resultado de la presión de selección para múltiples funciones, lo que generaba compromisos en lugar de adaptaciones ideales. Aunque este método proporcionó un nuevo enfoque para interpretar estructuras inusuales en fósiles, la investigación sobre la morfología funcional de los fósiles no aportó mucho nuevo a la comprensión de la evolución de la forma, ya que la suposición predominante era que toda morfología era adaptativa y había evolucionado para satisfacer una necesidad particular. Gould y Lewontin criticaron más tarde esta narrativa adaptacionista por carecer de rigor en la generación de hipótesis verificables.
Antes de adoptar la Konstruktions-Morphologie, Seilacher había publicado análisis cuidadosos de la morfología funcional de taxa fósiles en la década de 1960, combinando información de diversos ejemplares, como el trilobite Phacops, con huellas hechas por el mismo trilobite para demostrar que sus extremidades estaban adaptadas para evitar hundirse en el barro blando mientras caminaban. También aplicó el método de paradigma en el análisis de crinoides en un gran bloque de esquisto, mostrando que estaban adaptados para sujetarse a troncos flotantes en lugar de esperar a que el tronco se saturara y se hundiera en el fondo marino.
4.1.3.2 Konstruktions-Morphologie
En 1970, Adolf Seilacher ilustró su concepto de Konstruktions-Morphologie utilizando un triángulo (Fig. 4.3). Su contribución novedosa fue incorporar la arquitectura (Bautechnischer Aspekt) a la filogenia (Historisch-phylogenetischer Aspekt) y la adaptación (Ökologisch-adaptiver Aspekt), enriqueciendo así el “concepto combinado de forma y función morfológica” propuesto por Hermann Weber. Otros autores han utilizado diferentes términos para referirse a los vértices del triángulo de Seilacher; por ejemplo, David Raup se refirió al aspecto arquitectónico como el “factor estructural”, mientras que Thomas lo denominó “factor de crecimiento-morfogenético”. Sin embargo, el significado de estos términos es esencialmente el mismo.
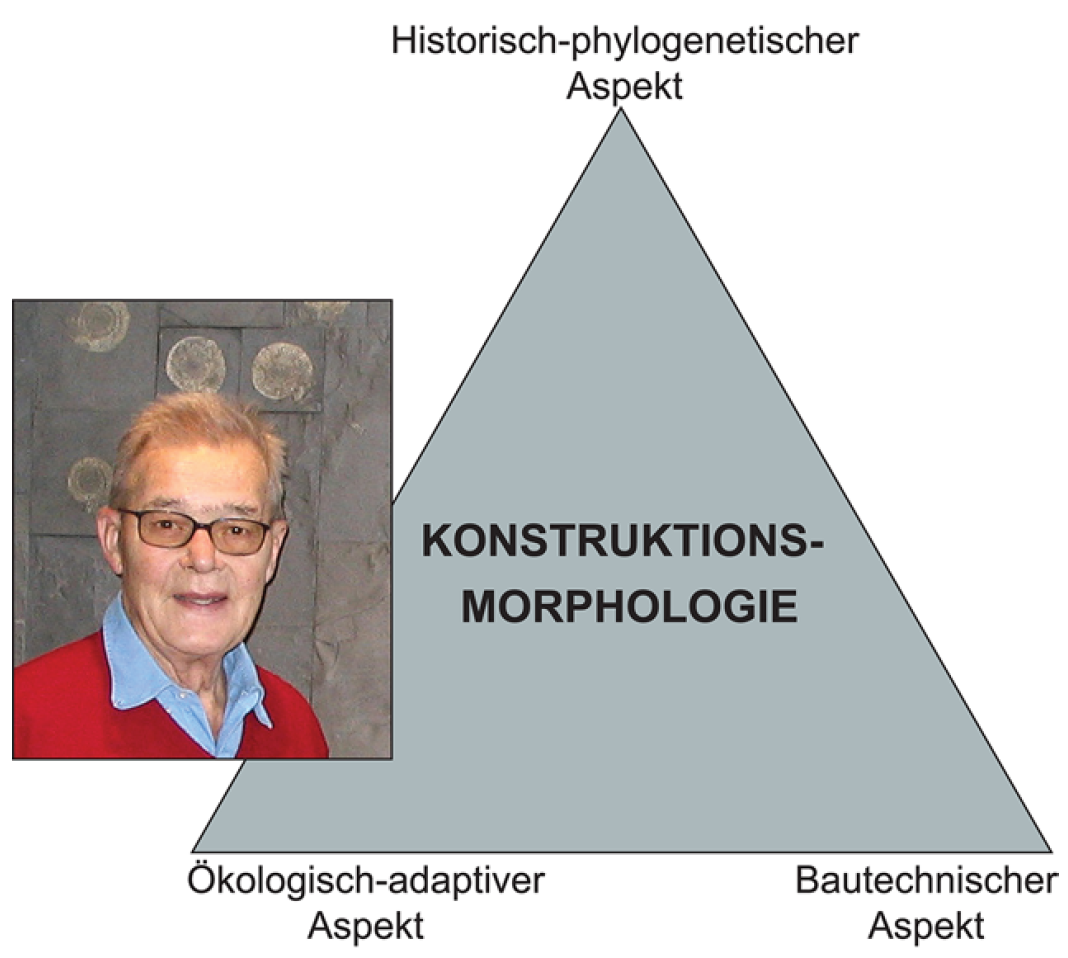
Figura 4.3: Adolf Seilacher (en Dotternhausen en 2008) con su original triángulo de la Konstruktions-Morphologie. Imagen tomada de Tamborino (2020).
La importancia de la visión de Seilacher radica en su ruptura con la tesis de que toda morfología refleja una adaptación a un entorno o modo de vida particular, resultado de la selección que actúa sobre una línea evolutiva. Seilacher consideraba la Konstruktions-Morphologie como un método de investigación más que un marco teórico, aunque reconocía que podía revelar patrones generales. Explicó que para comprender una situación específica en la evolución morfológica, es necesario conocer las “licencias”, es decir, las opciones y restricciones que los mecanismos morfogenéticos imponen a los planes de construcción establecidos al aproximarse a un diseño funcional apropiado.
El triángulo de Konstruktions-Morphologie de Seilacher representa un espacio conceptual en el que se pueden posicionar estructuras u organismos dependiendo del grado en que su forma esté determinada por el factor en cada vértice. No hay evidencia de que Seilacher haya trazado estructuras específicas en este triángulo; como han argumentado algunos autores, la morfología constructiva de Seilacher es “más un concepto heurístico, una hipótesis de trabajo, que una metodología analítica específica”. Sin embargo, la investigación de Cubo et al. (2008) es un caso singular que utiliza un enfoque estadístico para investigar cómo los factores históricos, funcionales y estructurales determinan la posición del crecimiento óseo en los amniotas dentro del triángulo de Seilacher.
4.1.3.3 La dimensión arquitectónica
Adolf Seilacher, en su enfoque de la Konstruktions-Morphologie, consideró una variedad de restricciones que influyen en la morfología de los organismos. Bajo su “Bautechnischer Aspekt” (aspecto arquitectónico), exploró cómo factores como los biomateriales y el crecimiento afectan la forma, prestando especial atención a estructuras que carecen de significancia adaptativa y que son el resultado de procesos de “autoorganización” o de la naturaleza de los materiales disponibles. Seilacher argumentaba que muchos patrones de crecimiento son generados por mecanismos que operan de manera autónoma, lo que se traduce en variabilidades que no están controladas genéticamente.
Un ejemplo clásico de esto es la espiral logarítmica que subyace en la morfología de las conchas de moluscos, un tema que fue objeto de simulaciones por parte de David Raup. Seilacher observó que estructuras similares, autoorganizadas y que carecen de significado adaptativo, también se encontraban en briozoos y foraminíferos, lo que subrayó que estas formas no eran convergentes ni indicaban relaciones filogenéticas.
La exploración de los aspectos arquitectónicos de la forma orgánica de Seilacher fue influenciada por su interacción con el arquitecto Frei Otto, quien buscaba estructuras en la naturaleza que pudieran aplicarse a la arquitectura. Seilacher estaba particularmente impresionado por la prevalencia de los pneus, estructuras infladas formadas bajo tensión, en una diversidad de organismos. Otto mostró que cuando los pneus tensionales se transforman en estructuras rígidas, automáticamente adquieren la forma adecuada para resistir el estrés compresional en la dirección opuesta”.
Seilacher también acuñó el término “ruido de fabricación” para referirse a características morfológicas generadas por mecanismos autoorganizados, como el empaquetamiento poligonal en panales de miel y corales compuestos. Otro fenómeno que observó fue el patrón de cebra, que aparece en superficies que se expanden y a menudo muestra asimetría incluso donde se espera simetría bilateral. Seilacher utilizó su propio ejemplo de las impresiones dactilares de sus dedos índices para ilustrar la variabilidad en estos patrones.
Además, identificó un patrón específico de cebra generado por la acreción marginal durante el crecimiento de las conchas, observable en moluscos bivalvos, donde las líneas oblicuas o en zigzag resultantes son diferentes en las válvulas izquierda y derecha. Aunque Seilacher no era biólogo del desarrollo, sugirió que estos patrones, que originan como “ruido”, podrían ser influenciados por la selección natural, comenzando con un control genético mínimo que con el tiempo permitiría la reproducción del patrón, aunque con resultados impredecibles.
De hecho, Gould y Lewontin destacaron la percepción de Seilacher al identificar las restricciones arquitectónicas como no adaptativas, pero como consecuencias necesarias de los materiales y diseños.
4.1.3.4 Las aplicaciones de Konstruktions-Morphologie a la diversificación ecológica de grupos actuales
Gould y Lewontin elogiaron el abandono por parte de Seilacher de un enfoque exclusivo en el programa de adaptación, argumentando que su trabajo merecía mucha más atención de la que había recibido. Sin embargo, Seilacher también mostró un gran interés por el papel de la adaptación en la generación de la forma. Uno de los ejemplos más citados de su concepto de Konstruktions-Morphologie se encuentra en su exploración de la diversificación ecológica de los bivalvos.
Seilacher se centró en cómo los bivalvos, descritos por él mismo como “dos platos conectados por una banda elástica”, superaron las limitaciones de su morfología heredada para colonizar sustratos blandos. Propuso que un ancestro similar a un lapa, que habitaba en sustratos duros, había “reutilizado” su pie para excavar a medida que las formas descendientes de bivalvos se trasladaron a sustratos más blandos. La forma y la escultura de las conchas evolucionaron hacia una mejora en la capacidad de enterramiento. En su escenario, algunos representantes de los bivalvos regresaron a los sustratos duros utilizando su estructura de fijación larval, el byssus, para unirse como adultos. Sin embargo, cuando estos organismos, ahora careciendo de un pie de excavación, volvieron a vivir en sedimentos como habitantes secundarios de sustratos blandos, adoptaron soluciones morfológicas inusuales. Algunos evolucionaron para ser “reclinadores”, desarrollando diversas estrategias para evitar hundirse en el sedimento, mientras que otros, como la famosa ostra fósil Gryphaea, ampliaron y pesaron significativamente una de sus valvas para proporcionar estabilidad mientras se recostaban sobre la superficie del sedimento.
Seilacher utilizó estas soluciones de los bivalvos que habitan sustratos blandos para mostrar cómo las nuevas adaptaciones evolucionan de manera convergente dentro de las limitaciones impuestas por los planes estructurales y los principios de fabricación. Esto representaba una morfología constructiva comparativa aplicada a un grupo como clave para las vías adaptativas, permitiendo así revelar sus trayectorias evolutivas. Aunque análisis moleculares más recientes sugieren que algunos detalles del esquema filogenético de Seilacher pueden ser incorrectos, su interpretación de las estrategias adaptativas no está en duda.
Además, Seilacher investigó la colonización de sustratos blandos por parte de los equinoideos, ampliando su interpretación del esqueleto de los equinodermos como un pneu con placas (similar a un globo lleno de agua) , en el contexto de la morfología constructiva de los dólares de arena (Clypeastroida). Al igual que los bivalvos, diferentes linajes de dólares de arena evolucionaron de manera convergente, lo que le permitió explorar soluciones morfológicas para habitar en sustratos blandos. Seilacher explicó que los dólares de arena se desvían de la forma estándar de pneu debido a distintas disposiciones de tensores que afectan su morfología. Análisis de formas y fuerzas sugieren que la forma de los equinoideos responde a las fuerzas ejercidas sobre su esqueleto durante el desarrollo, más que a una necesidad funcional de resistencia. Su modelo, aunque uno de muchos, es significativo porque ayuda a entender la diversidad de formas en los dólares de arena y su adaptación a diferentes estilos de vida y tipos de sustrato. Por tanto, Seilacher aportó una perspectiva valiosa sobre cómo las variaciones en la morfología de los dólares de arena están influenciadas por la forma en que se desarrollan y las fuerzas que actúan sobre ellos.
4.1.3.5 Los patrones divaricados de los bivalvos
En un interesante ejemplo, Seilacher (1972) demostró que la forma divaricada en la arquitectura de las conchas ocurre repetidamente en todos los grupos de moluscos, así como también en los braquiópodos (Fig. 4.4). Esta forma básica se manifiesta en una amplia variedad de estructuras, tales como: líneas ornamentales elevadas (que no son líneas de crecimiento, ya que no siguen el margen del manto en ningún momento), patrones de coloración, estructuras internas en la mineralización de calcita y surcos incisos. Aunque Seilacher no sabía qué genera este patrón, sostenía que el enfoque tradicional y casi exclusivo en el valor adaptativo de cada manifestación ha desviado la atención de las preguntas sobre su génesis en el crecimiento y ha impedido reconocerlo como un fenómeno general. El patrón parece surgir de alguna característica de irregularidad en el manto en crecimiento. Seilacher menciona que simulaciones por computadora simples pueden generar esta forma de esta manera. Sin embargo, el patrón general puede no ser una adaptación directa en absoluto.
Seilacher argumenta que la mayoría de las manifestaciones de este patrón son probablemente no adaptativas. Sus razones varían, pero generalmente parecen ser sólidas. Algunas se basan en observaciones de campo: por ejemplo, patrones de coloración que permanecen invisibles porque los moluscos que los poseen viven enterrados en sedimentos o están cubiertos por un periostraco tan grueso que los colores no pueden ser vistos. Otras razones se basan en principios más generales: la presencia de este patrón solo en individuos anómalos y patológicos y una variabilidad excesiva en comparación con la variabilidad mucho más reducida cuando la misma estructura general parece claramente funcional de acuerdo a evidencias complementarias.
En una minoría de casos, el patrón divaricado llega a ser funcional en cada una de las cuatro categorías observadas por Seilacher. Las costillas divaricadas pueden actuar como palas y anclajes en los procesos de excavación, pero en la mayoría de los casos, no están dispuestas de manera adecuada para cumplir dicha función en la mayoría de los moluscos bivalvos. Los patrones de color en forma de chevrons (líneas en forma de V) son miméticos en una especie, Pteria zebra, que vive en ramas de hidrozoos, donde la variabilidad de estos patrones se reduce considerablemente. Las chevrons mineralizadas probablemente sean adaptativas solo en una especie notable, el bivalvo Corculum cardissa (en otras especies, solo se observan como ejemplares anómalos o como productos post-mortem de la erosión de la concha). Este molusco es singularmente aplanado en dirección antero-posterior. Se encuentra en el sustrato, con la parte posterior hacia arriba. Distribuidos en su extremo posterior, se encuentran triángulos divaricados de mineralización, los cuales son translúcidos, mientras que el resto de la concha es opaco. Bajo estas “ventanas” viven algas endosimbióticas.
Toda la literatura anterior sobre las estructuras divaricadas se ha centrado en su posible significado adaptativo, y no ha encontrado tal adaptación en la mayoría de los casos. Sin embargo, Seilacher probablemente tenía razón al representar este patrón como una limitación arquitectónica fundamental, similar a los spandrels de las cúpulas que mencionaron Gould y Lewontin. De acuerdo con Seilacher, el patrón divaricado es una restricción arquitectónica fundamental. Ocasionalmente, dado que este patrón está presente, puede utilizarse de manera beneficiosa. Pero no podemos entender el patrón ni su significado evolutivo si consideramos estas adaptaciones secundarias y poco frecuentes como la razón de la existencia del patrón en sí mismo. En resumen, la presencia del patrón divaricado en las conchas de los moluscos y otros grupos no se debe a una adaptación específica, sino que surge como una consecuencia de restricciones arquitectónicas del crecimiento y la mineralización, y solo ocasionalmente puede ser aprovechada de manera funcional.
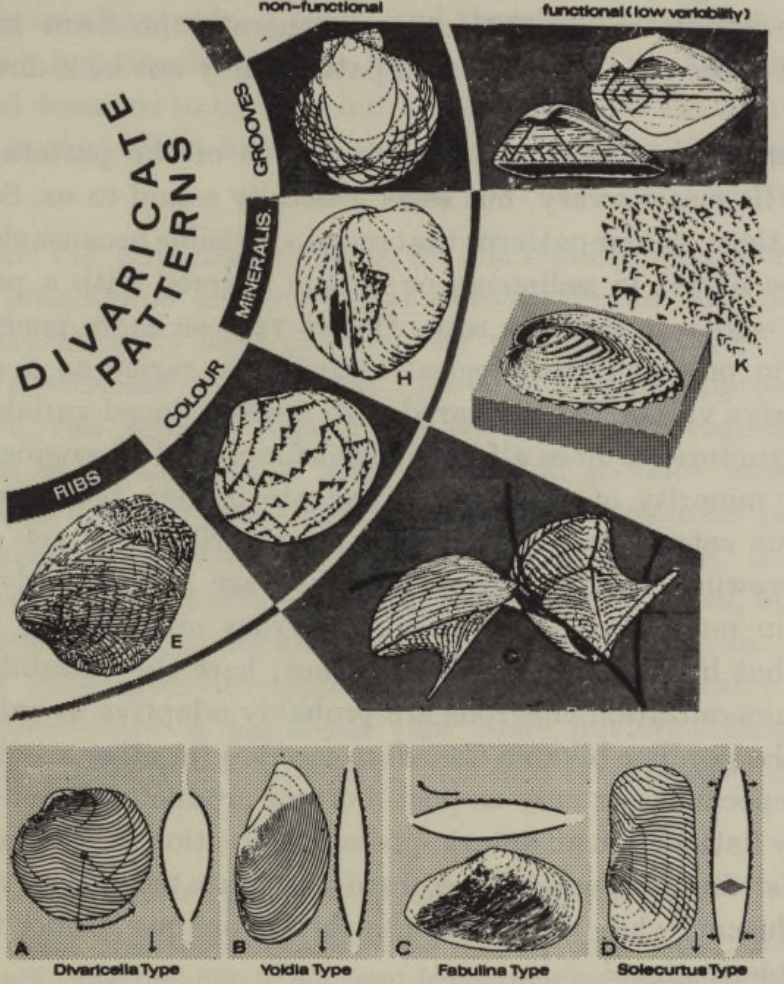
Figura 4.4: Rango de patrones divaricados en moluscos. (A-D) Costillas funcionales, aunque éstas son mucho menos comunes que las costillas no funcionales de la forma E. (E, F, H y L) Patrones no funcionales. (G) Pteria zebra. (K) Corculum cardissa. Imagen tomada de Gould & Lewontin (1979).
4.1.3.6 Las aplicaciones de Konstruktions-Morphologie a la Biota de Ediacara
En el ámbito de sus contribuciones sobre morfología, Seilacher es especialmente conocido entre los paleontólogos por su reinterpretación de los enigmáticos organismos de la Biota Ediacara, que fueron los primeros grandes organismos marinos en la Tierra, existiendo entre 580 y 541 millones de años atrás. Seilacher rechazó la idea predominante en su época de que estos organismos eran antepasados de diversos grupos de invertebrados vivos, argumentando que estaban unidos por una arquitectura común y que se extinguieron antes de la aparición de los metazoos en el Cámbrico.
Presentó su hipótesis radical durante varios años en conferencias antes de publicarla formalmente, primero denominando a estos organismos “Vendozoa” y más tarde creando un nuevo Reino, el Vendobionta, para clasificarlos. Los fósiles de Ediacara le permitieron analizar un grupo de organismos “desde principios puramente constructivos”, sin restricciones por afinidades o similitudes con formas vivas.
Seilacher interpretó la estructura de la mayoría de los organismos de Ediacara como un conjunto de cámaras similares a pneu, comparándolos con estructuras arquitectónicas inflables. Observó que estos organismos no mostraban evidencia de órganos internos, lo cual se reflejaba en sus patrones de crecimiento similares a fractales. Argumentó que su morfología bidimensional era una adaptación para maximizar la superficie y facilitar la difusión de nutrientes y oxígeno en sus cuerpos. Imaginó que generaban diferentes morfologías creciendo en una o dos direcciones (uni- o bipolarmente), o radialmente, con un crecimiento por expansión isométrica y la adición de nuevas cámaras en los bordes.
Aunque los datos moleculares indican que los metazoos bilaterales aparecieron antes que la Biota Ediacara, los fósiles de esta época muestran características únicas que sugieren que muchos de estos organismos no pudieron sobrevivir junto a los metazoos, posiblemente debido a la depredación y a cambios ambientales drásticos. Seilacher no consideró a la mayoría de los organismos de Ediacara como metazoos, pero analizó su ecología a través de analogías con comunidades bentónicas modernas. Sugirió que algunos organismos eran móviles y podían alimentarse de láminas microbianas, utilizando la osmotrofia como posible modo de alimentación. A pesar de que sus ideas sobre la Biota de Ediacara han sido refinadas per su afirmación fundamental de que muchos de estos grandes fósiles no pueden ser interpretados fácilmente como metazoos sigue siendo válida y constituye una de sus contribuciones más influyentes a la morfología fósil.
4.1.3.7 Morfodinámica
El concepto original de Konstruktions-Morphologie de Seilacher reconocía la evolución como un factor en la generación de respuestas adaptativas a presiones selectivas, pero no incorporaba una dimensión temporal. En 1991, Seilacher amplió su triángulo a un tetraedro al introducir una cuarta restricción, llamada “entorno efectivo”, convirtiéndose en el nuevo vértice. Esta ampliación dio lugar al término “morfodinámica”, que enfatiza que la morfología es un producto de la evolución y que cada organismo fósil representa un punto en una línea de tiempo continua. Seilacher no buscó analizar el entorno en sí, reconociendo la complejidad del “entorno efectivo” tanto para especies modernas como fósiles. La incorporación del cuarto vértice destaca la interdependencia entre organismo y entorno, formando un sistema interactivo que él denominó “organismo inclusivo”.
Introdujo el término morfodinámica en un simposio internacional sobre morfología constructiva y biomecánica en Bad Homburg en 1990, donde etiquetó su tetraédro no solo con las restricciones que definen los vértices, sino también con enfoques para “revelar relaciones morfodinámicas”. Seilacher estaba al tanto de los nuevos conceptos en genética y biología del desarrollo evolutivo, habiendo participado en la conferencia de Dahlem en 1981 sobre este tema, donde interactuó con destacados biólogos y paleontólogos.
Su diagrama de morfodinámica incorporó la genética del desarrollo y la mecánica del desarrollo como enfoques para interpretar aspectos arquitectónicos y fabricacionales, así como métodos moleculares y cladísticos para entender el papel de la filogenia. Veinticinco años después, Seilacher utilizó “morfodinámica” como título de su último libro, una recopilación de su obra sobre morfología, acompañada de sus icónicas ilustraciones, que fue publicada postumamente con la ayuda de Alan Gishlick. Sin embargo, el libro se basa en el enfoque singular de Seilacher sobre la morfología constructiva, donde el “entorno efectivo” recibe solo una mención breve, y los métodos de desarrollo evolutivo y moleculares son secundarios a su enfoque principal.
Lectura recomendada
Briggs, D. E. (2017). Seilacher, konstruktions‐morphologie, morphodynamics, and the evolution of form. Journal of Experimental Zoology Part B: Molecular and Developmental Evolution, 328(3), 197-206.
Tamborini, M. (2020). Challenging the adaptationist paradigm: Morphogenesis, constraints, and constructions. Journal of the History of Biology, 53(2), 269-294.
4.2 Evo-devo
4.2.1 Origen y desarrollo de evo-devo
La biología evolutiva del desarrollo, comúnmente conocida como evo-devo (por sus siglas en inglés, evolutionary developmental biology), es un campo de la biología que estudia la relación entre los procesos de desarrollo embrionario y la evolución de las formas de vida. Evo-devo busca entender cómo los cambios en los programas de desarrollo –es decir, los mecanismos que guían el crecimiento y la formación de los organismos desde el embrión hasta la adultez– contribuyen a la diversidad biológica y a la aparición de nuevas estructuras y formas a lo largo del tiempo evolutivo.
La formación de evo-devo como campo de estudio surgió a partir de un cambio significativo en las prácticas de investigación y la conceptualización de la biología de los organismos durante las últimas décadas. Hasta los años setenta y ochenta, la biología evolutiva y la biología del desarrollo se estudiaban por separado: la primera se centraba en las transformaciones de especies y poblaciones a lo largo del tiempo geológico, y la segunda en los cambios que ocurren durante el desarrollo individual. Integrar ambas disciplinas resultó controversial en sus inicios, debido a preocupaciones sobre la posible reaparición de ideas tipológicas y recapitulatorias.
El avance metodológico y conceptual a partir de los años ochenta permitió que se formulase un enfoque combinado, que unió varias subdisciplinas bajo un propósito común: entender cómo evoluciona el desarrollo de los organismos y de qué manera sus potencialidades internas guían la evolución. Así nació evo-devo, con un enfoque en las interacciones dinámicas entre genes, células y tejidos en sistemas en desarrollo, y su impacto en la evolucionabilidad de las poblaciones. Este enfoque permitió, por primera vez, el estudio del cambio en los organismos a través del análisis experimental de los procesos generativos que transforman los fenotipos.
Desde su establecimiento, evo-devo ha crecido para abarcar áreas como la genética molecular, la biología celular, la biofísica, el análisis cuantitativo y el modelado, así como el estudio de influencias ecológicas, conductuales y culturales en el desarrollo y la evolución. Este carácter profundamente interdisciplinario ha roto barreras entre disciplinas tradicionales, atrayendo el interés de historiadores y filósofos de la ciencia. La disciplina también ha logrado institucionalización a través de posiciones de investigación dedicadas, sociedades profesionales, conferencias, revistas especializadas y libros, todos indicadores de una disciplina madura.
Lectura recomendada
de la Rosa, L. N., & Müller, G. B. (2021). Evolutionary Developmental Biology. Springer.
4.2.2 Conceptos clave en evo-devo
4.2.2.1 Heterocronía
La heterocronía se refiere a la evolución en el tiempo de los rasgos de desarrollo, un concepto clave para explicar la diversidad fenotípica en biología evolutiva. Los procesos heterocrónicos permiten una gran diversificación de formas al modificar el tiempo y la velocidad del desarrollo de un rasgo durante la ontogenia. Cuando varios rasgos se ven afectados por el mismo proceso heterocrónico, pueden surgir rápidamente formas muy diferentes. Sin embargo, el concepto de heterocronía se ha vuelto complejo debido a la adición de términos y ajustes ad hoc para describir distintos tipos de patrones y procesos de desarrollo, lo que ha llevado a confusiones en su definición. A menudo, estos términos se aplican de manera imprecisa tanto a rasgos individuales como al organismo en su totalidad.
Para analizar los patrones de heterocronía, es fundamental contar con un contexto filogenético o paleontológico que permita interpretar los cambios en función de las condiciones de los descendientes y los ancestros. Aunque tradicionalmente el concepto de heterocronía se ha aplicado a la morfología, sus principios son igualmente aplicables a rasgos de comportamiento, ecológicos y fisiológicos. Reconocer patrones y procesos heterocrónicos en estas distintas disciplinas permitirá una integración más amplia del concepto en la biología y ofrecerá nuevas perspectivas sobre la evolución de los eucariotas.
4.2.2.1.1 Patrones de heterocronía
Los patrones de heterocronía abarcan los cambios en el desarrollo que pueden resultar en la truncación o extensión de este en los descendientes respecto a sus ancestros (Figs. 4.5, 4.6 y 4.7).
La truncación, o subdesarrollo (≈ pedomorfosis), ocurre cuando el inicio del desarrollo se retrasa (postdesplazamiento), cuando el desarrollo termina antes (hipomorfosis o progenesis), o cuando la tasa de desarrollo disminuye (deceleración, conocida como neotenia). Es común usar “progenesis” para referirse a la reproducción temprana y “neotenia” para el desarrollo somático más lento, aunque estos términos pueden ser engañosos al aplicarse a procesos específicos que no necesariamente afectan solo a tejidos reproductivos o somáticos.
Por otro lado, los patrones de desarrollo extendido (≈ peramorfosis) se logran mediante un inicio temprano del desarrollo (predesplazamiento), un final tardío (hipermorfosis), o un aumento en la tasa de desarrollo (aceleración). La clasificación de estos modos heterocrónicos permite entender los distintos patrones de cambio evolutivo en función de cuándo y cómo se alteran los tiempos y velocidades del desarrollo de los rasgos en los organismos.
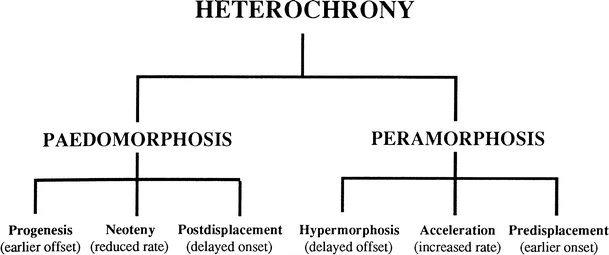
Figura 4.5: La clasificación jerárquica de la heterocronía. Imagen tomada de McNamara (2012).
Las diferencias entre las heterocronías de evento (como hipomorfosis, hipermorfosis, predesplazamiento y postdesplazamiento) y las heterocronías de tasa (aceleración y desaceleración) dependen de la perspectiva desde la cual se analice el fenómeno. Por ejemplo, el inicio de la maduración reproductiva es un evento puntual, pero el desarrollo del tejido gonadal implica una tasa de desarrollo que va desde su origen embrionario hasta la maduración. En algunos casos, un mismo evento puede marcar tanto el inicio de una nueva etapa de desarrollo como el fin de una anterior. Por lo tanto, los patrones heterocrónicos pueden clasificarse según la perspectiva, y esta flexibilidad permite adaptar las definiciones de heterocronía a su uso común.
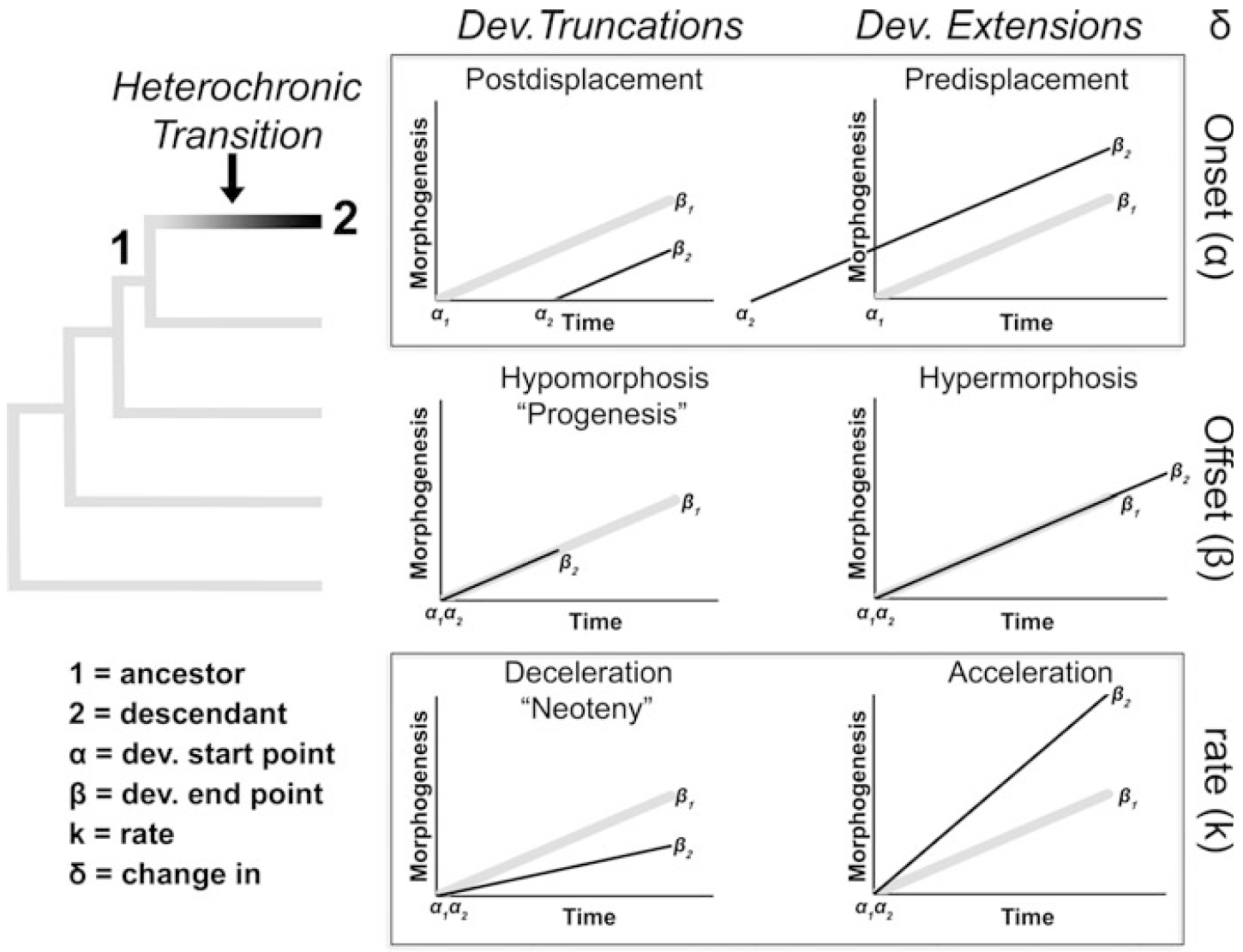
Figura 4.6: Modos heterocrónicos para lograr truncaciones y aceleraciones en el desarrollo. La filogenia a la izquierda muestra la trayectoria de desarrollo ancestral (en gris, 1) con una transición heterocrónica hacia un estado de desarrollo derivado (en negro, 2). A la derecha se representan seis trayectorias ontogenéticas alternativas, que ilustran cómo los cambios en el inicio del desarrollo (postdesplazamiento y predesplazamiento), el final del desarrollo (hipomorfosis e hipermorfosis) y la tasa de desarrollo (deceleración y aceleración) pueden modificarse en un descendiente (línea negra delgada, 2) en comparación con la trayectoria ancestral (línea gris gruesa, 1). Se indican los puntos de inicio (α) y final (β) del desarrollo. Imagen tomada de Bonett (2021).
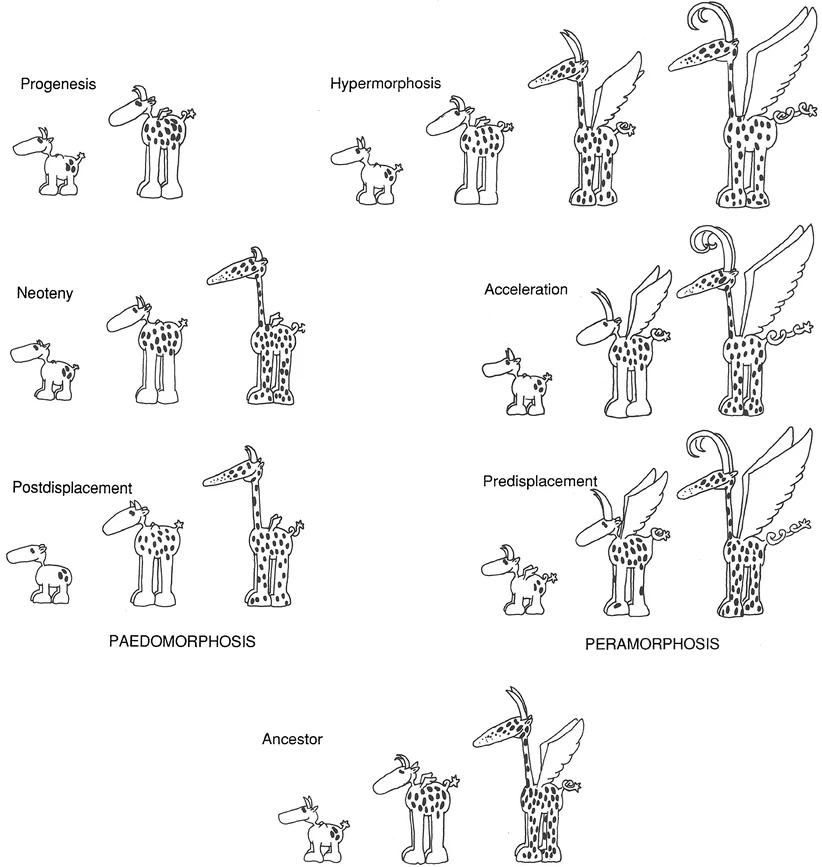
Figura 4.7: Un animal hipotético que, durante su ontogenia, experimenta una serie de cambios morfológicos. Los descendientes peramórficos desarrollan características que van ‘más allá’ de las del ancestro; los descendientes pedomórficos retienen rasgos juveniles ancestrales. En la hipermorfosis, el crecimiento se detiene más tarde; en la aceleración, los cuernos y la cola crecen más rápido; en el predesplazamiento, los cuernos y la cola comienzan a crecer antes. En la progénesis, el crecimiento se detiene más temprano; en la neotenia, los cuernos y la cola crecen a una tasa más lenta; en el postdesplazamiento, los cuernos y la cola inician su crecimiento relativamente más tarde. Imagen tomada de McNamara (2012).
4.2.2.1.2 Cambios heterocrónicos a lo largo de las etapas de vida
Los cambios heterocrónicos a lo largo de las etapas de vida son importantes porque pueden generar variaciones funcionales significativas en la biología de los organismos. Estos patrones de cambio pueden observarse al comparar la evolución ontogenética de al menos un rasgo en relación con otro que define una etapa de vida (como la maduración gonadal, que indica la adultez). Así, el desarrollo heterocrónico puede dar lugar a dos tipos de transiciones principales: la paedomorfosis y la peramorfosis.
La paedomorfosis ocurre cuando los adultos de los descendientes retienen características juveniles de sus ancestros, lo que puede lograrse a través de la aceleración reproductiva o la predisposición temprana a la maduración. Esto significa que el individuo alcanza la madurez sexual sin completar el desarrollo somático típico de los adultos de la especie ancestral. Un ejemplo se observa en las salamandras, donde la maduración temprana lleva a adultos con morfologías larvales sin cambios en el tamaño corporal entre los adultos metamórficos y los paedomórficos. Otra vía hacia la paedomorfosis es la truncación del desarrollo somático, como en algunas salamandras que pierden la metamorfosis sin alterar la edad de maduración, generando individuos que mantienen características larvales en la adultez.
Por el contrario, la peramorfosis implica que los rasgos de los adultos ancestrales se desarrollen en etapas juveniles de los descendientes, lo cual puede lograrse mediante la aceleración somática o el desplazamiento temprano del desarrollo somático. En salamandras con desarrollo directo, por ejemplo, el desarrollo somático es muy rápido en comparación con el de los ancestros que presentan un ciclo bifásico; este cambio permite completar la metamorfosis antes de la eclosión. Algunos linajes pueden incluso evitar ciertas etapas ancestrales, como en especies que omiten el esqueleto larval típico y desarrollan directamente una estructura adaptada para la alimentación terrestre.
Ambas direcciones de cambio —paedomorfosis y peramorfosis— muestran que los patrones heterocrónicos son flexibles y pueden evolucionar de diferentes maneras en función de las necesidades y presiones ecológicas de la especie. Aunque teóricamente se ha argumentado que la pedomorfosis y la peramorfosis deberían ocurrir con frecuencias aproximadamente iguales, los estudios del registro fósil sugieren que este equilibrio no siempre se observa en la práctica siendo uno u otro tipo prevalente dependiendo del grupo y sus particularidades.
4.2.2.1.3 Heterocronía y alometría
La relación entre tamaño y forma, conocida como alometría, surge de las diferentes tasas de crecimiento entre distintas partes del cuerpo o en diferentes ejes de una misma estructura. Por ejemplo, un hueso puede volverse relativamente más largo y delgado si crece más rápidamente en un eje que en otro. Si la forma y el tamaño relativos de una estructura permanecen constantes durante la ontogenia en relación con el tamaño corporal del organismo, se dice que el crecimiento es isométrico. Aunque pocos organismos crecen de manera isométrica, algunos rasgos individuales, como ciertos elementos del esqueleto de los vertebrados, pueden hacerlo. Sin embargo, generalmente una estructura como un hueso cambia de forma y tamaño en relación con el organismo completo durante su desarrollo. Si el hueso aumenta de tamaño relativo, el crecimiento se denomina alometría positiva; si hay una reducción relativa en el tamaño, se denomina alometría negativa.
Existe una estrecha relación entre alometría y heterocronía, ya que esta última implica cambios no solo en el tiempo, sino también en la forma y el tamaño. Las modificaciones en las tasas de crecimiento, como la aceleración y la neotenia, provocan cambios alométricos. La extensión o contracción del período de crecimiento—es decir, hipermorfosis o progenesis—acentúa o reduce los efectos de los cambios alométricos. Por lo tanto, los organismos que experimentan cambios alométricos pronunciados durante su desarrollo tienen más probabilidades de generar morfologías adultas muy diferentes en sus descendientes si las tasas o duraciones del crecimiento han cambiado.
Por ejemplo, al comparar el cráneo del perro doméstico (Canis familiaris) con el del gato doméstico (Felis catus) (Figs. 4.8 y 4.9), se observa que el cráneo del perro experimenta un cambio alométrico positivo pronunciado durante la ontogenia, especialmente por el fuerte crecimiento del hocico. Mediante la manipulación artificial de las tasas y tiempos de crecimiento, se ha producido una amplia variedad de razas con morfologías craneales sustancialmente diferentes. Por ejemplo, perros pequeños como los chihuahuas o los spaniels King Charles son muy pedomórficos, mientras que los grandes lobos irlandeses son peramórficos. En contraste, la magnitud del cambio alométrico es mínima en el gato doméstico, por lo que las razas no difieren mucho en morfología. En la naturaleza, ocurre el mismo efecto: los organismos que producen una mayor variación debido a un cambio alométrico ontogenético más amplio generan más material para la selección natural, lo que conduce a la evolución de una amplia gama de descendientes.
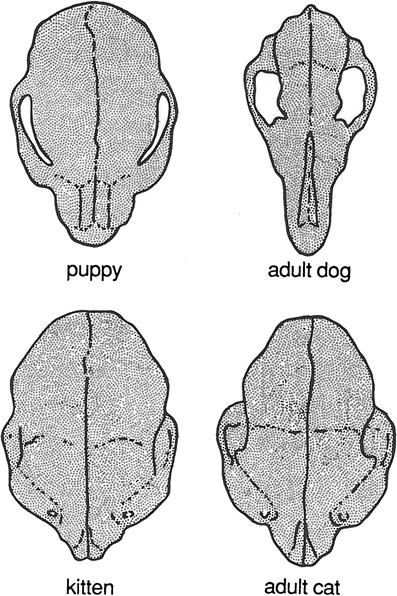
Figura 4.8: Las diferencias proporcionales en las formas del cráneo de perros y gatos domésticos durante su crecimiento son notables. Los perros experimentan cambios de forma mucho más significativos que los gatos, lo que explica la mayor diversidad de formas craneales entre las distintas razas caninas en comparación con las felinas. Imagen tomada de McNamara (2012).
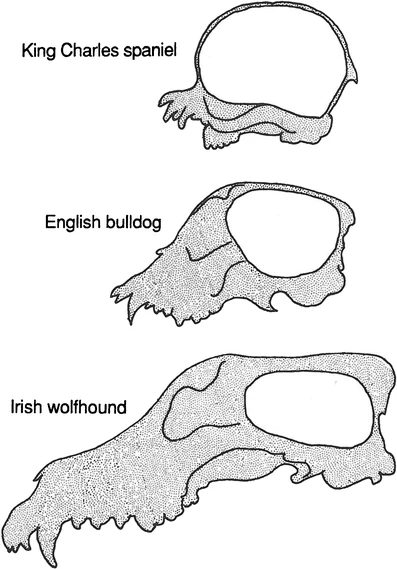
Figura 4.9: Las diferencias significativas en la forma del cráneo entre distintas razas de perros, observadas en sección longitudinal, se relacionan con el grado de pedomorfosis (arriba) o peramorfosis (abajo). En general, cuanto más corta es la cara, más abovedado es el cráneo. Imagen tomada de McNamara (2012).
Puede resultar difícil de imaginar, pero tu pequeño y peludo perro pequinés que te mira con ojos adorables es en realidad un lobo. Esto se debe a que, como una de las numerosas razas de perros domésticos (muchas de las cuales fueron seleccionadas inadvertidamente por humanos por rasgos heterocrónicos particulares), “evolucionó” a partir de un lobo. Todos los rasgos presentes en los primeros perros domésticos, que datan de al menos 30,000 años, se encuentran en los cachorros de lobo: hocicos acortados; frentes más empinadas y anchas; y menor tamaño corporal (Fig. 4.10). Por lo tanto, los perros domésticos son esencialmente lobos pedomórficos. Sin embargo, es poco probable que el hombre del Mesolítico haya estado seleccionando estos rasgos. Es más probable que estuviera seleccionando aspectos del comportamiento juvenil del lobo. Este comportamiento juvenil más dócil es más probable que haya acercado a los cachorros de lobo a los humanos. La socialización en los perros se desarrolla mejor entre las tres y las doce semanas de edad, cuando se forman los lazos primarios. Aquellos que no se vinculan con los humanos probablemente fueron ahuyentados o eliminados.
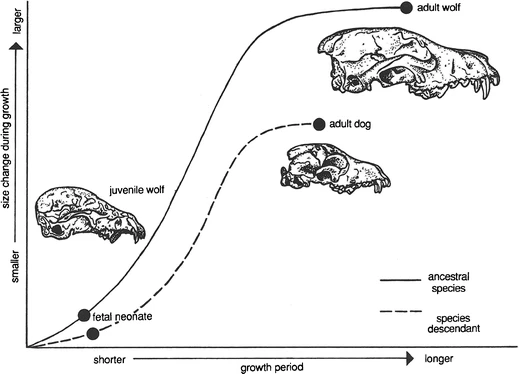
Figura 4.10: La evolución del perro doméstico a partir del lobo mediante pedomorfosis muestra la similitud del cráneo de los primeros perros domésticos adultos con el de los lobos juveniles. Imagen tomada de McNamara (2012).
4.2.2.1.4 Heterocronía y gigantismo
Un patrón común en la evolución es el aumento del tamaño corporal, conocido como la “regla de Cope”. La peramorfosis puede contribuir a este incremento a través de hipermorfosis y aceleración.
Estudios en linajes de bivalvos y ammonites del Jurásico han demostrado tendencias hacia un aumento del tamaño corporal, posiblemente debido a estos procesos peramórficos. Patrones similares se han observado en foraminíferos, primates y otros mamíferos, así como en pterosaurios.
En los dinosaurios, especialmente en los terópodos como los tiranosáuridos, la combinación de aceleración e hipermorfosis ha sido clave en la evolución de tamaños corporales gigantes. Por ejemplo, el Tyrannosaurus rex alcanzaba aproximadamente 5.5 toneladas, creciendo rápidamente durante los primeros cuatro años de vida, con una ganancia de alrededor de dos kilogramos por día, y alcanzando la madurez a los 18.5 años. En comparación, otros tiranosáuridos como Albertosaurus y Gorgosaurus eran más pequeños, con tasas de crecimiento más lentas y madurez alcanzada entre los 14 y 16 años. Estos hallazgos sugieren que la evolución del gigantismo en dinosaurios terópodos fue facilitada por una combinación de tasas de crecimiento aceleradas y una extensión del período de crecimiento, permitiendo alcanzar tamaños corporales mayores. Este patrón contrasta con otros reptiles, como cocodrilos y lagartos, donde el gigantismo se logró principalmente a través de la hipermorfosis.
4.2.2.1.5 Heterocronía y dimorfismo sexual
El dimorfismo sexual, es decir, las diferencias morfológicas y de tamaño entre machos y hembras de una misma especie, a menudo surge debido a variaciones en las tasas de crecimiento o en los tiempos relativos de maduración sexual, lo que implica procesos de heterocronía. Por ejemplo, en el pez cofre azul del Océano Índico (Strophiurichthys robustus), los machos desarrollan cuerpos más ovalados y patrones ondulados durante su desarrollo, mientras que las hembras retienen las características juveniles de cuerpos en forma de diamante y patrones de manchas, evidenciando pedomorfosis en las hembras. Un caso más extremo se observa en peces rape de aguas profundas, como Photocorynus, donde el macho es significativamente más pequeño, conserva rasgos juveniles y vive como parásito adherido a la cabeza de la hembra. En gasterópodos eulímidos, los machos están tan reducidos que residen dentro del cuerpo de la hembra, funcionando casi exclusivamente como testículos. Este tipo de dimorfismo sexual extremo, con machos pedomórficos que viven en o sobre las hembras, es común en varios invertebrados marinos. En primates, como los macacos, se han documentado ejemplos menos extremos de dimorfismo sexual inducido por heterocronía. En muchos escarabajos, los machos desarrollan estructuras prominentes como patas delanteras agrandadas, mandíbulas u otros apéndices cefálicos debido a alometría positiva, donde los machos crecen durante períodos más prolongados que las hembras, resultando en estas estructuras destacadas. En el escarabajo pelotero Onthophagus ferox, los machos presentan cuernos que las hembras no tienen, y dentro de los machos existen dos morfos: uno pequeño sin cuernos y otro más grande con cuernos, demostrando dimorfismo masculino derivado de la escala alométrica del tamaño de los cuernos. Un fenómeno similar se observa en el weta arbóreo de Nueva Zelanda (Hemideina crassidens), donde dos morfos masculinos difieren en armamento cefálico, reducido en las hembras, debido a variaciones en la duración del crecimiento durante la ontogenia. El tamaño que alcanza un escarabajo y, por ende, el desarrollo de grandes estructuras en los machos, depende en parte de la disponibilidad de alimento. En el escarabajo de hongo bifurcado (Bolitotherus cornutus), las larvas que se alimentan de hongos más nutritivos emergen como adultos de mayor tamaño y desarrollan cuernos más grandes. Incluso el estado de desarrollo del hongo afecta las tasas de crecimiento del escarabajo; las larvas que se alimentan de hongos jóvenes crecen más rápido y alcanzan mayor tamaño corporal que aquellas que consumen hongos más viejos y menos nutritivos.
4.2.2.1.6 Heterocronía y la evolución de la estrategias de vida
La heterocronía influye en las estrategias de historia de vida de los organismos, afectando aspectos como el tamaño al nacer, la tasa de crecimiento, la edad y tamaño en la madurez, la cantidad y tamaño de la descendencia, y la longevidad. Estas características se agrupan en un continuo conocido como r–K, que clasifica las estrategias de vida según las condiciones ambientales:
Estrategias r: Propias de entornos impredecibles y efímeros. Los organismos r-seleccionados maduran rápidamente, tienen vidas cortas y cuerpos pequeños, y producen numerosas crías. Estas características suelen resultar de procesos heterocrónicos como la progenesis o la aceleración del desarrollo.
Estrategias K: Asociadas a ambientes estables y predecibles. Los organismos K-seleccionados presentan maduración tardía, vidas largas y cuerpos grandes, produciendo pocas crías de mayor tamaño. Estas características pueden surgir de la hipermorfosis (extensión del período de crecimiento) o de la neotenia (reducción de la tasa de desarrollo).
Un ejemplo de cómo la heterocronía afecta las estrategias de vida se observa en los roedores heterómidos de América del Norte:
Microdipodops (ratón canguro): Alcanza la madurez rápidamente, con un cuerpo pequeño de aproximadamente 8 cm, mostrando rasgos pedomórficos. Esto indica una estrategia r, favorecida por la progenesis.
Dipodomys (rata canguro): Tiene un desarrollo más lento, vida más larga y cuerpo más grande (unos 20 cm), con períodos de gestación más largos y camadas más pequeñas, características de una estrategia K. Esto sugiere una neotenia en su desarrollo.
Orthogeomys (tuza): Alcanza tamaños de hasta 30 cm mediante una extensión del período de crecimiento, reflejando una hipermorfosis.
Además, factores externos como el cambio climático pueden inducir cambios heterocrónicos que afectan las estrategias de vida. Por ejemplo, en la planta anual Brassica en California, una sequía de cinco años seleccionó plantas que florecen más temprano y con tallos más delgados, mostrando una adaptación heterocrónica a nuevas condiciones ambientales.
En resumen, la heterocronía es fundamental en la evolución de las estrategias de historia de vida, permitiendo a los organismos adaptarse a diversas condiciones ambientales mediante modificaciones en el desarrollo y la reproducción.
4.2.2.1.7 Heterocronía disociada y compromisos en el desarrollo
El cambio heterocrónico puede resultar en una combinación de características pedomórficas y peramórficas en un mismo organismo, fenómeno conocido como heterocronía disociada. Esta mezcla sugiere la existencia de compensaciones o compromisos en el desarrollo, donde la evolución de ciertos rasgos peramórficos se equilibra con la aparición de características pedomórficas. Algunos ejemplos de heterocronías disociadas incluyen:
Tyrannosaurus rex: Este dinosaurio presentaba un cuerpo y cráneo de gran tamaño, desarrollados de manera peramórfica, mientras que sus extremidades anteriores eran notablemente reducidas, mostrando rasgos pedomórficos. Esta reducción podría no tener una ventaja adaptativa directa, pero puede haber sido una compensación evolutiva para facilitar el desarrollo de su gran tamaño corporal y cráneo.
Evolución humana: La “hipótesis del tejido costoso” propone que, en humanos, el incremento del tamaño cerebral, que requiere un alto consumo energético, se compensó con la reducción de otros órganos metabólicamente demandantes, como el tracto digestivo. Esto permitió un equilibrio energético que facilitó el desarrollo de un cerebro más grande sin aumentar el metabolismo basal.
Aves ratites (como el avestruz y el emú): Estas aves muestran un aumento peramórfico en el tamaño corporal y de las extremidades posteriores, acompañado de una reducción pedomórfica de las alas, resultando en la pérdida de la capacidad de vuelo. Este patrón sugiere una compensación evolutiva donde el desarrollo de extremidades posteriores robustas para la locomoción terrestre se equilibró con la simplificación de las alas.
Estos ejemplos ilustran cómo las compensaciones en el desarrollo pueden influir en la evolución de diferentes especies, equilibrando la aparición de rasgos avanzados con la retención o simplificación de otros, en respuesta a limitaciones energéticas y funcionales.
4.2.2.1.8 Heterocronía y novedades evolutivas
La heterocronía ha sido propuesta como un factor clave en la aparición de novedades evolutivas significativas. En la década de 1920, Walter Garstang sugirió que los vertebrados podrían haber evolucionado a partir de una larva similar a la de los tunicados mediante pedomorfosis. Los tunicados adultos son organismos sésiles que se adhieren a superficies duras, mientras que sus larvas presentan características propias de los vertebrados, como notocorda, hendiduras branquiales y una cola postanal propulsora. Garstang propuso que la maduración sexual temprana en estas larvas habría llevado a la retención de su forma juvenil en la etapa adulta, permitiendo su reproducción en ese estado.
La progenesis, que implica una maduración sexual precoz, se considera un proceso heterocrónico especialmente relevante en la generación de novedades evolutivas. Esto se debe a que no solo produce diferencias morfológicas pronunciadas entre ancestros y descendientes, sino que también puede influir en estrategias de vida centradas en la maduración temprana. Sin embargo, otros procesos heterocrónicos, como la neotenia y la hipermorfosis, también desempeñan roles significativos en la macroevolución. Por ejemplo, el gran lagarto terrestre del Pleistoceno australiano, Varanus (Megalania) prisca, que medía alrededor de siete metros y pesaba más de media tonelada, alcanzó su enorme tamaño retrasando la madurez en tres o cuatro años en comparación con otros varánidos.
La pérdida de extremidades en serpientes y ballenas también ilustra la importancia de la pedomorfosis en la evolución de novedades morfológicas. En estos casos, es probable que procesos como la neotenia o el postdesplazamiento, o una combinación de ambos, hayan contribuido a estos cambios. La prevalencia de la pedomorfosis en la evolución de novedades morfológicas se debe, en parte, a las marcadas diferencias entre las formas embrionarias tempranas y las adultas, en comparación con las diferencias observadas en morfologías adultas resultantes de la hipermorfosis. No obstante, es posible que cambios peramórficos en etapas tempranas del desarrollo, como un inicio anticipado del crecimiento de ciertos rasgos, también jueguen un papel crucial en la formación de novedades morfológicas.
En ocasiones, la aparición de nuevos grupos de organismos puede atribuirse a heterocronías disociadas, donde la combinación de rasgos pedomórficos y peramórficos da lugar a organismos radicalmente diferentes. Un ejemplo clásico es la evolución de las aves a partir de dinosaurios. Fósiles del Cretácico temprano en Liaoning, China, revelan que muchos dinosaurios pequeños tenían plumas. Es posible que las plumas estuvieran presentes no solo en algunos dinosaurios adultos pequeños, sino también en juveniles de formas más grandes. Si este fuera el caso, dinosaurios pequeños con plumas, como Sinosauropteryx y Caudipteryx, podrían interpretarse como dinosaurios pedomórficos. De manera similar, la retención de plumas en aves puede considerarse resultado de la pedomorfosis. Las primeras aves, que evolucionaron entre el Jurásico tardío y el Cretácico temprano, exhiben otros rasgos pedomórficos, como la reducción de algunos dígitos, tamaño corporal pequeño, retención de huesos no fusionados, cráneo alargado y grácil, órbitas grandes y una caja craneana relativamente grande. Sin embargo, una característica crucial de aves tempranas, como Archaeopteryx, es la posesión de extremidades anteriores muy desarrolladas que permitieron el vuelo, formadas mediante procesos peramórficos que afectaron estos elementos esqueléticos específicos.
4.2.2.1.9 Pedomorfoclinas y peramorfoclinas
La heterocronía desempeña un papel crucial en la generación de tendencias evolutivas debido a la direccionalidad inherente tanto en el desarrollo de los organismos como en la evolución. Una tendencia evolutiva que muestra caracteres progresivamente más pedomórficos de ancestros a descendientes se denomina pedomorfoclina (Figs. 4.11 y 4.12). Si los descendientes evolucionan con rasgos cada vez más peramórficos, se llama peramorfoclina (Fig. 4.13).
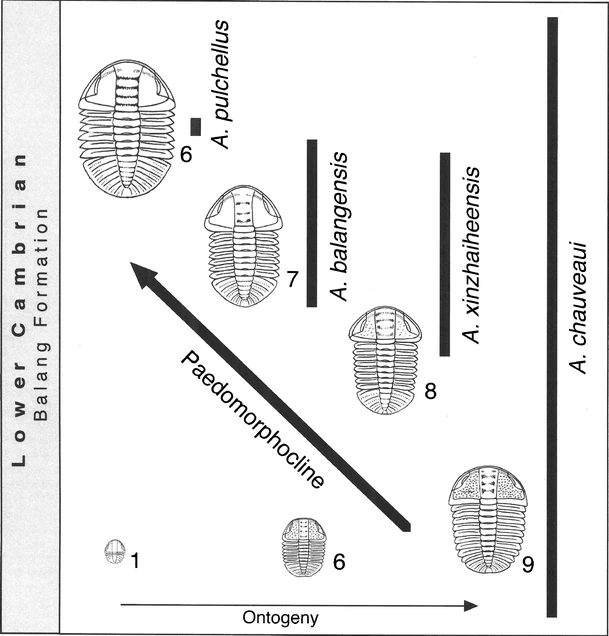
Figura 4.11: Evolución pedomórfica de las especies del trilobite orictocéfalido Arthricocephalus del Cámbrico Inferior en la provincia de Guizhou, China. Los números se refieren a los segmentos torácicos. Imagen tomada de McNamara (2012).
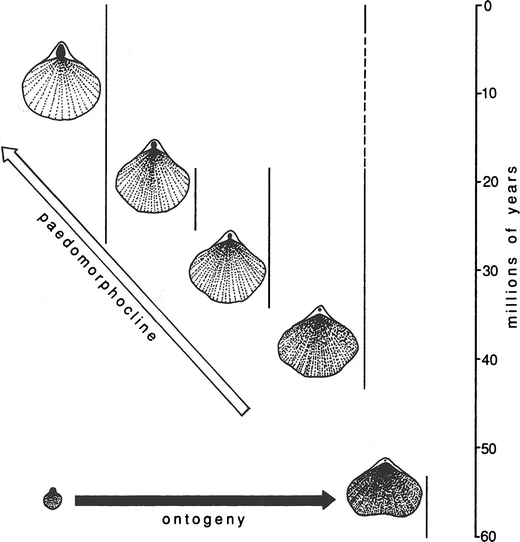
Figura 4.12: A lo largo de aproximadamente 60 millones de años, los braquiópodos australasianos Tegulorhynchia y Notosaria han experimentado una evolución cada vez más pedomórfica, formando una tendencia evolutiva conocida como pedomorfoclina. La retención de características más pedomórficas ha permitido que especies sucesivas colonicen aguas progresivamente más someras. Las formas más antiguas habitaban en aguas profundas y tranquilas, mientras que la especie al final de la pedomorfoclina habita en la zona intermareal. Imagen tomada de McNamara (2012).
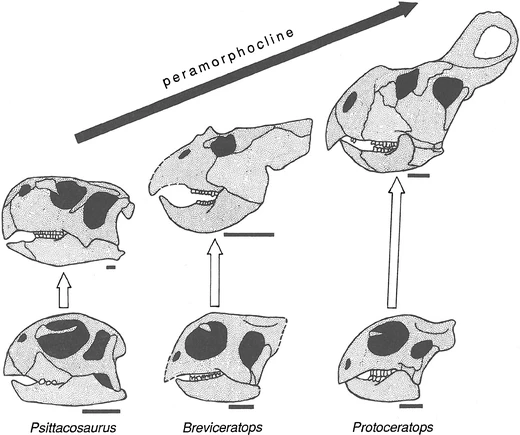
Figura 4.13: Evolución peramórfica de los dinosaurios protoceratópsidos. Imagen tomada de McNamara (2012).
4.2.2.1.10 Reconstrucción de patrones heterocrónicos
La reconstrucción de patrones heterocrónicos permite entender cómo los cambios en el desarrollo han evolucionado a lo largo del tiempo en distintos linajes. Comprender estos patrones implica una cuidadosa interpretación de la dirección de los cambios evolutivos, es decir, si el desarrollo de los descendientes ha sido acelerado o retrasado en comparación con sus ancestros. Un aspecto crucial en este proceso es el correcto conocimiento de las condiciones de desarrollo ancestrales, ya que cualquier error en la interpretación puede llevar a conclusiones incorrectas sobre la naturaleza y dirección de los cambios evolutivos. Para realizar esta reconstrucción, se requiere de un contexto filogenético apoyado por evidencia paleontológica y comparativa que permita trazar la evolución de los rasgos.
La identificación de estados ancestrales depende de un árbol filogenético confiable y datos de rasgos relevantes de múltiples especies representativas de un grupo. A menudo, el análisis filogenético ayuda a visualizar cómo un rasgo ha evolucionado a lo largo del tiempo en diferentes linajes, pero recopilar datos ontogenéticos para múltiples especies es complejo, especialmente para rasgos moleculares o de alta variabilidad. En estos casos, el emparejamiento de eventos o “event pairing” resulta útil para analizar secuencias de desarrollo sin necesidad de contar con la edad exacta en que aparece un rasgo. Este método facilita el análisis de trayectorias de desarrollo en un contexto evolutivo, aunque requiere una cantidad significativa de datos de secuencias de desarrollo en varios taxones para garantizar una reconstrucción precisa de las condiciones ancestrales.
La morfometría geométrica es útil para analizar cambios de desarrollo al estudiar trayectorias de forma mediante puntos de referencia homólogos en distintas estructuras, capturando cambios heterocrónicos en múltiples rasgos. Sin embargo, trabajar con datos complejos presenta desafíos estadísticos, ya que los rasgos no siempre evolucionan de forma coherente. El análisis también puede realizarse utilizando datos de edad ontogenética como rasgos continuos, aplicando modelos estadísticos para evaluar la dirección y magnitud de los cambios en el desarrollo. Aunque idealmente se usa la edad real, a veces se recurre a la talla como sustituto, aunque esto puede ser impreciso, ya que el crecimiento en sí puede verse afectado por patrones heterocrónicos.
Un fenómeno interesante es el de la isomorfosis, que se presenta cuando patrones heterocrónicos divergentes producen un fenotipo similar, lo que puede deberse a la evolución convergente o a la deriva en el sistema de desarrollo. Esta convergencia se observa en salamandras que exhiben paedomorfosis a través de mecanismos diferentes. La convergencia heterocrónica demuestra que trayectorias de desarrollo alternativas pueden llevar al mismo resultado fenotípico, y esto puede analizarse de forma comparativa en distintos clados para evaluar si el mecanismo de convergencia es el mismo o si las rutas de desarrollo divergieron para producir patrones similares. Este enfoque permite entender la repetibilidad y las limitaciones de la diversificación evolutiva.
Dado que la heterocronía es central para entender la evolución de la diversidad fenotípica, el desarrollo de métodos analíticos avanzados para manejar datos ontogenéticos es fundamental. Estos métodos permitirán analizar mejor cómo los patrones heterocrónicos influyen en la integración de rasgos y en la diversificación de especies, proporcionando una comprensión más profunda de los procesos de cambio evolutivo en el desarrollo y de su papel en la diversidad biológica.
4.2.2.1.11 La escala apropiada para la inferencia hetrocrónica
La inferencia de patrones heterocrónicos en biología evolutiva depende de la escala temporal adecuada para interpretar correctamente los cambios en el desarrollo entre ancestros y descendientes. Para lograr inferencias precisas, es crucial considerar el intervalo de tiempo entre estos grupos, ya que la dirección de los cambios en el desarrollo —como la aceleración o desaceleración de ciertos rasgos— puede ser más evidente cuando las tasas de cambio evolutivo son bajas. En estos casos, los patrones pueden trazarse claramente, facilitando la identificación de un cambio heterocrónico específico que afectó la morfología o el desarrollo de los organismos en la línea evolutiva.
Por el contrario, cuando las tasas de cambio son elevadas, es posible que se hayan producido múltiples reversiones y modificaciones en los patrones de desarrollo a lo largo del tiempo. Estas reversiones pueden dificultar una interpretación única, ya que los cambios de dirección en el desarrollo complican la tarea de distinguir una trayectoria evolutiva estable. En este contexto, se hace más difícil identificar patrones consistentes de cambio, y el análisis de los datos debe enfocarse en los cambios acumulados y no en una secuencia lineal de transformación.
La escala adecuada también permite una aplicación más precisa de los términos de la heterocronía, como paedomorfosis (retención de características juveniles en adultos) y peramorfosis (exageración de características adultas en etapas juveniles). Tradicionalmente, estos términos se aplicaban a cambios evolutivos entre especies (interespecíficos), pero en contextos adecuados también pueden aplicarse a cambios dentro de una misma especie (intraespecíficos), siempre que sea posible establecer la dirección del cambio. Esta flexibilidad en la terminología se debe a que hoy en día las filogenias no se limitan exclusivamente a relaciones entre especies, sino que también pueden reconstruirse entre poblaciones de una misma especie.
Además, es esencial tener en cuenta que los cambios en el desarrollo a lo largo del tiempo deben estar alineados con la historia evolutiva y el contexto ecológico de cada especie. Al aplicar correctamente la escala temporal y la dirección de cambio en el desarrollo, es posible obtener una comprensión más profunda de cómo estos patrones heterocrónicos han moldeado la diversidad fenotípica y los procesos evolutivos a través de múltiples linajes.
4.2.2.1.12 Procesos subyacentes
Los patrones heterocrónicos pueden aportar información valiosa sobre la evolución de los mecanismos de desarrollo subyacentes. Un patrón heterocrónico que muestra un cambio en el inicio de un evento de desarrollo puede indicar modificaciones en la expresión de genes o proteínas, en la sensibilidad o liberación hormonal, en la diferenciación celular o en las condensaciones celulares. Los cambios en el fin de un evento de desarrollo también pueden señalar variaciones en la expresión de genes o proteínas, en la sensibilidad o liberación hormonal, o en la interrupción de la diferenciación celular. Las heterocronías de tasa pueden estar influenciadas por diferencias en las tasas de diferenciación o morfogénesis. Los propios procesos pueden ser de naturaleza heterocrónica. Por ejemplo, una señal inductiva puede difundirse a través de menos capas de tejido en comparación con los ancestros, lo cual es análogo a una hipomorfosis o desaceleración. Sin embargo, es importante señalar que no todos los mecanismos heterocrónicos producirán patrones heterocrónicos a nivel morfológico, y no todos los patrones de desarrollo heterocrónicos necesariamente derivan de un mecanismo heterocrónico.
Los patrones de desarrollo suelen representarse como trayectorias lineales, aunque la morfogénesis puede mostrar cambios abruptos y comportamientos asintóticos. Comparar trayectorias ontogenéticas completas permite detectar variaciones sutiles en la divergencia del desarrollo, lo que aporta información sobre posibles mecanismos de desarrollo. Un patrón truncado de desarrollo somático que aparece tarde en la ontogenia (por ejemplo, en la adultez) sugiere un mecanismo que reduce o retrasa la tasa de diferenciación o morfogénesis, sin eliminarla por completo. En algunas salamandras, la “paedomorfosis facultativa” permite la reproducción en forma larval, pero los individuos pueden completar la metamorfosis bajo estrés ambiental o con hormonas tiroideas. Por el contrario, las salamandras con “paedomorfosis obligada” retienen permanentemente rasgos larvales, sin importar su edad o la administración de hormonas. Esto ilustra que el estudio de patrones heterocrónicos puede informar hipótesis sobre cómo se regulan los procesos, indicando que los mecanismos heterocrónicos que controlan la paedomorfosis facultativa afectan la tasa o el momento de la morfogénesis somática o la reproducción, mientras que la metamorfosis en los paedomorfos obligados queda desplazada de manera permanente.
La correlación entre diferentes rasgos en individuos de una población o a lo largo de una filogenia indica una integración, que podría ser producto de restricciones selectivas, genéticas, funcionales o de desarrollo. Fuertes correlaciones de desarrollo entre muchos rasgos sugieren que están influenciados por un mecanismo sistémico (global). Existen varios mecanismos que pueden producir estos patrones, como la reestructuración ontogenética, donde las alteraciones en las etapas tempranas del desarrollo repercuten a lo largo de toda la ontogenia. Además, cambios en señales de desarrollo, como hormonas con múltiples objetivos genéticos, también pueden provocar cambios heterocrónicos globales. Otros mecanismos de desarrollo pueden ser más limitados (locales) en su control. Se pueden identificar mecanismos heterocrónicos locales primarios que influyen directamente en el rasgo de interés y mecanismos heterocrónicos regionales secundarios que son subproductos indirectos de cambios en otros aspectos del desarrollo. En general, la falta de correlación entre rasgos sugiere que no están acoplados y podrían evolucionar de forma independiente. Sin embargo, es importante reconocer que la independencia es relativa cuando se consideran rasgos dentro de un mismo individuo, ya que incluso los componentes del desarrollo que se consideran mayormente independientes pueden ejercer una influencia considerable entre sí.
4.2.2.1.13 Integración de la heterocronía
La integración de la heterocronía en estudios evolutivos proporciona una visión más amplia sobre cómo los cambios en el tiempo y la tasa de desarrollo han impactado en la evolución y diversificación de los organismos. Los patrones de evolución fenotípica a menudo muestran cambios abruptos, en contraste con la idea darwiniana de cambios graduales. Estos cambios puntuales pueden explicarse por la evolución de mecanismos heterocrónicos globales, que afectan simultáneamente múltiples rasgos, dando la apariencia de un cambio drástico en el fenotipo de una generación a otra. Este fenómeno también se observa en especies actuales, donde las variaciones heterocrónicas entre padres e hijos o entre poblaciones generan diferencias fenotípicas significativas en poco tiempo.
La heterocronía también se analiza a partir de datos de desarrollo y del registro fósil, proporcionando información sobre los mecanismos endógenos que producen diferencias ontogenéticas. No obstante, el contexto ecológico es fundamental para comprender por qué ciertos fenotipos prevalecen en la naturaleza. Comparar las variaciones en el tiempo y la tasa de desarrollo permite probar hipótesis sobre factores ecológicos que influyen en los patrones heterocrónicos, como la divergencia de nicho, la competencia, las interacciones tróficas y la selección sexual. Factores como el momento de la reproducción y la fecundidad afectan directamente la ecología de poblaciones y pueden impulsar la evolución de ciertos patrones de desarrollo.
A nivel interespecífico o entre poblaciones, el análisis comparativo filogenético es clave para identificar causas ecológicas que han modelado la evolución de patrones heterocrónicos. Por ejemplo, en algunas especies de salamandras, los ambientes estables favorecen el desarrollo paedomórfico, mientras que en regiones con alta precipitación, el ciclo de vida bifásico (acuático-terrestre) es más común. La paedomorfosis, aunque adaptativa en ambientes estables, tiende a reducir el rango geográfico y la capacidad de dispersión, lo cual limita la diversificación dentro de estos linajes.
Los efectos de la heterocronía no se limitan a rasgos morfológicos, sino que también pueden observarse en comportamientos, rasgos ecológicos y fisiológicos, que pueden estar directamente ligados a los procesos de desarrollo. El estudio de la evolución ontogenética en distintos niveles de organización biológica permite integrar disciplinas diversas, y aporta una comprensión más completa de los mecanismos evolutivos que han dado forma a la diversidad de los organismos actuales.
Lectura recomendada
Bonett, R. M. (2021). Heterochrony. Evolutionary developmental biology: a reference guide, 15-28.
McNamara, K. J. (2012). Heterochrony: the evolution of development. Evolution: Education and Outreach, 5, 203-218.
4.2.2.2 Exaptación y evo-devo
La exaptación del desarrollo es un concepto fundamental en la biología evolutiva del desarrollo (evo-devo) que explica cómo características preexistentes del programa de desarrollo pueden facilitar cambios evolutivos. El concepto de exaptación en el desarrollo establece que ciertas características genéticas, celulares o morfogenéticas, previamente establecidas y mantenidas por la selección interna, pueden ofrecer una ventaja adaptativa en nuevas funciones evolutivas. Este proceso es esencial para entender cómo los organismos responden y se adaptan no solo a presiones ambientales externas, sino también a los requisitos internos y a la integración de su propio sistema de desarrollo.
Desde la Síntesis Evolutiva, los científicos han debatido sobre la importancia de los factores internos frente a los externos en la evolución. Los factores externos incluyen presiones ambientales que actúan sobre el organismo de forma directa (selección externa), mientras que los factores internos abarcan las necesidades de integración y funcionalidad entre las distintas partes de un organismo (selección interna). Esta selección interna es una fuente de las llamadas “restricciones del desarrollo”, que limitan las posibilidades fenotípicas de un organismo debido a los requisitos y limitaciones del sistema de desarrollo.
La exaptación en el desarrollo implica la capacidad del sistema de desarrollo para aprovechar características preexistentes que pueden facilitar la evolución de nuevos fenotipos. Este concepto se apoya en la distinción entre “preadaptación”, que sugiere la existencia de adaptaciones latentes para futuras funciones, y “exaptación”, que describe el proceso evolutivo por el cual estos rasgos preexistentes asumen nuevas funciones adaptativas.
La adaptación en el programa de desarrollo puede ocurrir en varios niveles, cada uno de los cuales influye en la evolución del organismo de formas distintas. A continuación, se detallan estos niveles, proporcionando ejemplos específicos de cómo la exaptación en cada nivel facilita la innovación evolutiva:
Selección en la Regulación Génica: La regulación génica en el desarrollo es como un sistema de control preciso: cada gen debe activarse en el momento y lugar adecuados. Para esto, se usan secuencias reguladoras, llamadas elementos “cis”, que actúan como interruptores para encender o apagar genes en respuesta a ciertos factores de transcripción (proteínas que controlan la actividad de los genes). A veces, la variación aleatoria en estas secuencias puede generar nuevos puntos de unión para estos factores, permitiendo que un gen se active en una nueva área sin afectar el desarrollo general. Esto facilita cambios evolutivos en el plan corporal de un organismo. Por ejemplo, si un gen Hox (importante en la organización del cuerpo) se expresa en un área distinta gracias a un cambio en los elementos reguladores, puede producirse una nueva estructura sin consecuencias graves, aprovechando características preexistentes.
Selección en el Comportamiento Celular: Cada célula debe transformarse en el tipo de célula correcto, de acuerdo con las instrucciones posicionales y ciertas cadenas de regulación génica. En algunos casos, hay grupos de células que están en la ubicación correcta para convertirse en un nuevo tipo de tejido, lo que facilita la aparición de estructuras diferentes. Por ejemplo, los huesos dérmicos (huesos formados en la piel) de animales como cocodrilos o armadillos surgen porque hay células en la capa dérmica que ya tienen la capacidad de transformarse en hueso. Este “grupo de células adecuado” es una exaptación que facilita la evolución de nuevos huesos dérmicos en lugares distintos del cuerpo.
Selección en la Diferenciación de Tejidos: Cada célula del organismo debe diferenciarse correctamente en función de las señales posicionales y de cascadas de factores de transcripción. La diferenciación de tejidos puede ser facilitada por la existencia de grupos de células que pueden adaptarse a funciones nuevas, como se observa en los huesos dérmicos de vertebrados (e.g., cocodrilos, armadillos). Para que un hueso dérmico evolucione en una posición nueva, debe existir un grupo de células mesenquimatosas con una identidad adecuada para facilitar la transición a tejido óseo dérmico, actuando así como una exaptación para la evolución de nuevas estructuras dérmicas.
Selección en Movimientos Morfogenéticos: Durante el desarrollo, las células y los tejidos se mueven para ocupar sus lugares finales en el organismo. Estos movimientos dependen de cómo se adhieren y cambian de forma las células. Un ejemplo en serpientes muestra cómo estos movimientos facilitan la evolución de colmillos en una posición diferente: el desarrollo de los colmillos frontales requirió que los tejidos y señales en la nueva ubicación estuvieran “preparados” para recibir el diente, facilitando la transición.
Selección en la Sincronización de Eventos: La sincronización de los procesos de desarrollo es clave para que el embrión se forme correctamente. Si un evento cambia su momento, otros deben ajustarse. La heterocronía es este tipo de cambio en el tiempo, donde ciertos eventos se adelantan o retrasan, permitiendo nuevas formas sin alterar el desarrollo básico. Un ejemplo es el cambio en artrópodos entre segmentación anamórfica (segmentos se forman tras el nacimiento) y epimórfica (todos los segmentos presentes antes de eclosionar), facilitado por exaptaciones que permitieron reorganizar el tiempo de los eventos sin problemas.
Los genes altamente conservados tienden a evolucionar a tasas muy lentas debido a la fuerte selección estabilizadora que los mantiene sin cambios. Sin embargo, cuando estos genes cambian, es indicativo de que existen otros factores que facilitan dicho cambio sin que afecte negativamente la funcionalidad del organismo. Esta adaptación en genes conservados puede considerarse como evidencia de exaptación, donde factores reguladores o estructurales preexistentes en el sistema de desarrollo permiten que estos genes adopten nuevas funciones evolutivas sin comprometer su rol fundamental.
En evo-devo, el concepto de co-opción de genes se refiere a cuando un gen o una red génica que originalmente tiene una función específica en el organismo es “reutilizado” para cumplir una función nueva y distinta. Esto es un ejemplo de exaptación del desarrollo, donde características preexistentes se adaptan para asumir roles novedosos. Por ejemplo, en las mariposas, ciertos genes que originalmente se usaban para definir la segmentación del cuerpo (es decir, marcar dónde terminan y comienzan las distintas secciones del cuerpo) fueron “co-optados” para crear patrones ocelados en sus alas. Estos patrones, como los círculos que parecen ojos, tienen una función visual distinta, probablemente relacionada con la defensa o el camuflaje. Esto ocurre porque los genes que son útiles para organizar estructuras repetitivas, como segmentos del cuerpo, pueden exaptarse para formar otras estructuras complejas repetitivas. La co-opción de estos genes permite que el organismo evolucione nuevas características sin tener que desarrollar genes completamente nuevos desde cero; en cambio, “reutiliza” los que ya existen, aprovechando su potencial para crear innovaciones evolutivas.
En este sentido, la exaptación es fundamental para la aparición de novedades evolutivas, las cuales no emergen de la nada, sino que representan una diversificación rápida de estructuras o sistemas preexistentes. Esto ocurre típicamente cuando una presión selectiva dramática incide sobre una estructura que ya posee las características necesarias para ser modificada.
En conclusión, la exaptación del desarrollo describe cómo las características del programa de desarrollo, inicialmente seleccionadas o generadas de forma neutra, pueden ser reutilizadas para nuevos roles evolutivos. Estas características incluyen desde dominios de expresión génica hasta identidades celulares y sincronización de eventos. Aunque la identificación de exaptaciones es compleja debido a la dificultad para rastrear la secuencia de eventos evolutivos, el concepto amplía la comprensión de cómo los sistemas de desarrollo pueden adaptarse internamente a nuevas presiones evolutivas, facilitando la evolución de innovaciones morfológicas y funcionales que caracterizan la diversidad biológica.
Lectura recomendada
Chipman, A. D. (2021). Developmental exaptation. Evolutionary developmental biology: a reference guide, 29-38.
4.2.2.3 Concepto de “Carga” en evo-devo
El núcleo de la biología evolutiva del desarrollo se centra en la interacción entre desarrollo y evolución. Aunque esta relación puede parecer sencilla, encierra una serie de conceptos complejos y problemas asociados, especialmente en términos de causalidad. Tradicionalmente, se ha entendido que los procesos de desarrollo son moldeados por las fuerzas evolutivas, incluidas la selección natural y otras presiones, lo que convierte al desarrollo en un producto complejo de la evolución. Sin embargo, la idea contraria –que el desarrollo pueda influir en la evolución– ha sido menos evidente y más controvertida en la historia de la biología. El reto de evo-devo es entonces entender cómo las dinámicas del desarrollo pueden, a su vez, dar forma a la evolución.
Esta relación está representada por una serie de conceptos que se agrupan bajo el término de “restricciones”, un conjunto de ideas que han evolucionado para explicar cómo los límites impuestos por el desarrollo pueden guiar o limitar el cambio evolutivo. Estas ideas tienen raíces profundas en la biología, desde el principio biogenético de Haeckel hasta la heterocronía de Gavin de Beer y las teorías de restricciones del desarrollo de autores como Stephen J. Gould, Pere Alberch y otros. Cada uno de estos conceptos busca entender los factores internos que influyen en la evolución, complementando las fuerzas evolutivas externas.
El concepto de “carga” (burden), desarrollado por Rupert Riedl en su obra Order in Living Organisms, es parte central de este conjunto de ideas en evo-devo. Riedl propuso que ciertos caracteres, debido a sus interdependencias y conexiones dentro del organismo, acumulan responsabilidades biológicas que restringen su capacidad de cambiar. Esta “carga” limita la capacidad evolutiva de ciertos rasgos, especialmente los que están profundamente integrados en el plan corporal, o Bauplan, de una especie, ya que cualquier cambio en estos rasgos podría desestabilizar toda la estructura del organismo. Así, Riedl integró este concepto en el marco de la selección interna, una idea que considera que ciertos caracteres son preservados no solo por la selección natural, sino también por presiones internas de organización.
El concepto de carga de Riedl se relaciona con ideas clásicas de la morfología del siglo XIX, como las leyes embriológicas de von Baer, que resaltan cómo los caracteres generales aparecen primero en el desarrollo, o el principio de conexiones de Geoffroy Saint-Hilaire, que explora cómo las conexiones estructurales afectan la organización. Además, conceptos contemporáneos como el entrenchment de Wimsatt y el sesgo del desarrollo de Wallace Arthur presentan paralelismos con la idea de carga. Wallace Arthur, por ejemplo, sugiere que, junto con la selección direccional para adaptarse a ambientes específicos, existe una selección estabilizadora que mantiene la integración interna de los organismos. Tanto la carga como otros conceptos relacionados (entrenchment, restricciones, y sesgos del desarrollo) son consecuencias de la selección interna, cuya influencia recae especialmente en las primeras etapas del desarrollo, donde los caracteres fundamentales se establecen.
4.2.2.3.1 ¿Qué es la carga o burden?
Desde antes de la teoría evolutiva, los anatomistas comparativos observaron que grandes grupos de animales y plantas comparten características estructurales comunes que forman lo que se conoce como el Bauplan o “plan corporal”. Este conjunto de rasgos característicos define la estructura básica de un grupo taxonómico, como la columna vertebral en los vertebrados, compuesta por vértebras que no solo protegen la médula espinal, sino que también actúan como punto de anclaje para músculos y otros huesos, estructurando el eje principal del cuerpo. Además, durante el desarrollo embrionario, los vertebrados comparten características transitorias, como la formación de la mórula, la gástrula y el notocordio, que son esenciales para mantener esta estructura básica.
El estudio de las restricciones del desarrollo intenta explicar cómo estas características fundamentales surgen y se mantienen estables en grupos taxonómicos a lo largo de cientos de millones de años. En este contexto, el concepto de carga (o burden) se enfoca en si los caracteres tienen diferentes posibilidades de transformación evolutiva. Así, se plantea la pregunta: ¿pueden algunos caracteres cambiar más fácilmente que otros a lo largo de la evolución? La teoría de carga de Riedl intenta responder esta pregunta al abordar el “origen y mantenimiento del Bauplan”. Si bien el origen de estos caracteres es complejo de estudiar, el mantenimiento puede entenderse mejor: Riedl propone que algunos caracteres están fuertemente restringidos y tienden a mantenerse invariantes en la evolución, mientras que otros tienen mayor libertad para cambiar y, por tanto, son más evolutivos.
Riedl identificó dos fuentes principales de esta carga o limitación evolutiva:
Generalidad Embriológica: Se refiere a la idea de que algunos caracteres están profundamente integrados en las primeras etapas del desarrollo embrionario. Riedl argumenta que los caracteres que aparecen en etapas tempranas del desarrollo (por ejemplo, estructuras que se forman en la fase de gástrula o neurulación) son más difíciles de modificar sin alterar el desarrollo del organismo, debido a su papel fundamental en el proceso. Esta idea se basa en las leyes embriológicas de von Baer, que establecen que los caracteres generales aparecen antes en el desarrollo que los específicos.
Dependencias Funcionales: Este tipo de carga se basa en las interacciones entre distintos elementos dentro del organismo. A medida que un carácter adquiere más conexiones funcionales y dependencias de otros rasgos, su capacidad de cambiar evolutivamente disminuye. Este tipo de carga es especialmente relevante para los conceptos modernos de integración morfológica y redes reguladoras de genes (GRNs), ya que estas interacciones a nivel de desarrollo molecular y morfogenético limitan la capacidad de los caracteres para evolucionar de forma independiente.
Raff denomina estas fuentes de carga como “restricciones verticales” y “horizontales”, respectivamente. Si bien la evidencia embriológica ha cuestionado algunas ideas sobre la generalidad embriológica, las interdependencias funcionales se consideran fundamentales para la evo-devo moderna. En esta línea, se propone también un sistema de clasificación y cuantificación de la carga en términos de burden rank (rango de carga), utilizando análisis de redes anatómicas. Este enfoque permite evaluar con precisión las limitaciones evolutivas en un contexto filogenético, midiendo la interdependencia de los caracteres y su potencial evolutivo.
4.2.2.3.2 Generalidad embriológica
Durante el desarrollo embrionario, los procesos morfogenéticos ocurren en una secuencia rigurosa y precisa, comenzando con características generales, como la formación de la mórula y la gastrulación, seguidos por etapas más específicas, como la neurulación, que da forma a estructuras típicas en los embriones. Estas características generales, observadas por Karl Ernst von Baer en el siglo XIX, son comunes en animales triploblásticos, y cualquier perturbación en su formación puede tener consecuencias graves para el organismo.
Von Baer formuló varias leyes a partir de sus observaciones: (1) los caracteres generales de un grupo de animales aparecen antes en el embrión que los caracteres específicos; (2) los caracteres menos generales se desarrollan a partir de los más generales; (3) cada embrión se diferencia gradualmente y no pasa por las formas de otros grupos; (4) el embrión de un organismo de mayor complejidad no se asemeja al de otros, sino solo a su propio embrión.
Estas leyes inspiraron el concepto de “etapa filotípica”, una fase intermedia y altamente conservada en el desarrollo de muchos organismos. Durante las etapas tempranas del desarrollo, los embriones pueden mostrar variabilidad significativa en los primeros pasos, como la segmentación y gastrulación. Sin embargo, todos deben pasar por una etapa filotípica común, donde las interacciones entre procesos de desarrollo generan una estructura básica. En vertebrados, esta etapa filotípica corresponde a la neurulación tardía. Tras esta fase, los procesos morfogenéticos se vuelven específicos para cada especie, lo que ha llevado a describir esta variabilidad en desarrollo como un “reloj de arena filogenético”: en las etapas tempranas y tardías del desarrollo existe mayor capacidad de variación, mientras que la etapa intermedia o filotípica se mantiene altamente restringida y menos alterable.
Este modelo desafía algunos aspectos del concepto de carga propuesto por Riedl, pues aunque los caracteres aparecen temprano en el desarrollo, esto no implica necesariamente que sean menos variables. Raff señala que la diversidad en las formas en que los embriones inician su desarrollo es prueba de que la variación puede ocurrir incluso en las etapas tempranas. Así, el modelo de reloj de arena sugiere que la mayor variación ocurre antes y después de la etapa filotípica, mientras que los procesos posteriores se vuelven cada vez más específicos y regulados por especie. Por tanto, el primer aspecto de la carga, basado en la generalidad embriológica, solo es aplicable a partir de la etapa filotípica, donde se observa una mayor consistencia estructural.
4.2.2.3.3 Dependencias
De los dos aspectos centrales del concepto de carga, la cuestión de las dependencias es la más relevante, convirtiendo a la carga en un tema importante para la investigación en evo-devo. Las dependencias biológicas se relacionan con conceptos como la integración morfológica y con la organización jerárquica de la regulación génica en el desarrollo, como las redes reguladoras de genes (GRNs). Tanto la integración morfológica como las GRNs son áreas activas y a menudo interconectadas en evo-devo, explorando cómo las interacciones entre elementos anatómicos o funcionales durante el desarrollo influyen en la capacidad de un rasgo para cambiar evolutivamente.
Las dependencias en este contexto representan relaciones entre partes de sistemas anatómicos o funcionales, como la conexión entre articulaciones en los huesos o el crecimiento regulado hormonalmente de los órganos. Cuantas más conexiones o relaciones tiene una parte con otras, mayor será su “carga” y, en consecuencia, más limitada su capacidad para evolucionar de forma independiente. Esta carga acumulada actúa como un peso que restringe la evolucionabilidad de la parte, es decir, su capacidad para adaptarse o cambiar (Fig. 4.14).
En evo-devo, la evolucionabilidad se refiere a la capacidad de un elemento anatómico para cambiar bajo cualquier tipo de influencia evolutiva, especialmente durante la embriogénesis, en contraste con la definición de la genética de poblaciones, donde se entiende como la capacidad de generar diversidad genética adaptativa sujeta a selección. Para evo-devo, el concepto de carga es fundamental en la restricción de la evolucionabilidad: cuantas más dependencias tenga un rasgo, más limitado estará su potencial de cambio, lo que afecta directamente la posibilidad de variación fenotípica. Así, la carga actúa como un filtro estructural que organiza las variaciones potenciales de manera no aleatoria, creando un vínculo importante entre la biología comparativa y la teoría de la evolución neodarwiniana.
Figura 4.14: Esquema de la formación de un plan corporal a través del aumento de la carga. A medida que avanza la evolución, el carácter 1 desarrolla cada vez más dependencias hacia nuevos caracteres, volviéndose tan ‘cargado’ que cualquier cambio tendrá grandes consecuencias. Finalmente, el carácter 1 se convierte en parte del plan corporal y, debido a esta alta carga, pierde capacidad de evolucionar o cambiar. Imagen tomada de Rasskin-Gutmanand & Esteve-Altava (2021).
4.2.2.3.4 Cuantificando la carga a través del análisis de redes anatómicas
En la última década, la teoría de redes se ha aplicado al estudio de la anatomía, desarrollando una metodología conocida como análisis de redes anatómicas (AnNA, de sus siglas en inglés Anatomical Network Analysis), que examina las conexiones entre elementos anatómicos. Esta metodología analiza patrones de articulación entre huesos, como en el cráneo, donde cada hueso se conecta a otros mediante suturas y articulaciones. La cantidad de estas conexiones proporciona una medida natural de “carga”: cuanto más conectado está un hueso, mayor es su carga. Además de la cantidad de conexiones, otras métricas, como la centralidad o el coeficiente de agrupamiento, pueden usarse para evaluar la carga.
En el cráneo humano, con 21 huesos, algunos tienen muchas conexiones (como el esfenoides, etmoides y frontal), mientras que otros, como los nasales y lacrimales, tienen pocas (Fig. 4.15). Estos patrones de conectividad organizan el cráneo en dos módulos: el facial y el craneal. Para explicar la relación entre el número de contactos de un hueso y su importancia en la organización del cráneo, se propuso la hipótesis del rango de carga. Esta sugiere que cuantos más contactos tiene un hueso, mayor es su carga y, por tanto, menos probable es que cambie con el tiempo evolutivo. Este concepto explica, por ejemplo, por qué muchos huesos se han fusionado a lo largo de la historia evolutiva de los mamíferos. La fusión puede considerarse el destino final de los huesos con una gran carga. De hecho, los huesos fusionados podrían dar lugar a una arquitectura craneal completamente nueva, que podría decirse que ha surgido de las “fuerzas” ejercidas por la carga de los huesos individuales del ancestro.
La hipótesis del rango de carga predice que los módulos con menos conexiones serán más evolutivos que aquellos con más. En el contexto del cráneo humano, se espera que el módulo facial tenga mayor evolucionabilidad morfológica que el módulo craneal, dado que sus huesos tienen menos contactos entre sí. Los estudios morfométricos en primates apoyan esta idea, mostrando que las regiones con menor conectividad en el módulo craneal son menos plásticas evolutivamente que las del módulo facial.
Esta hipótesis destaca que la complejidad de los módulos influye en su conservación evolutiva. Los módulos más complejos, con mayor interacción entre huesos, tienen más dependencias funcionales y de desarrollo que restringen su variabilidad. Por el contrario, la menor complejidad del módulo facial permite mayor especialización y variación fenotípica. Esto sugiere que los módulos anatómicos con menos conexiones están más predispuestos a la variación y adaptación evolutiva.
Figura 4.15: Esquema del cráneo humano y su modelo de red correspondiente que destaca la diferencia en el número de conexiones o rango de carga entre los huesos etmoides y lacrimal. Imagen tomada de Rasskin-Gutmanand & Esteve-Altava (2021).
4.2.2.3.5 Críticas
La teoría de la carga de Riedl, aunque ofrece un punto de partida para destacar la importancia del desarrollo en la evolución de organismos multicelulares, no es una explicación perfecta dentro del marco neodarwinista. Como suele ocurrir con nuevas hipótesis, varios autores han planteado críticas al concepto de carga. A continuación, se presentan tres de estas objeciones:
Algunos autores han cuestionado la validez de la teoría en relación con la jerarquía de los procesos de desarrollo. Esta crítica ha sido abordada en parte mediante el modelo de reloj de arena del desarrollo, el cual sugiere que, sólo al examinar el desarrollo a partir de una etapa intermedia (estadío filotípico) en lugar de desde el inicio del embrión, los eventos morfogenéticos tempranos parecen ser menos variables que los tardíos.
Otros han señalado que el concepto de carga, tal como se formuló originalmente, podría implicar que los caracteres acumulan carga hasta un punto de irreversibilidad, lo que podría conducir a callejones sin salida evolutivos. Sin embargo, como se mencionó anteriormente, elementos íntimamente conectados, que eventualmente pueden fusionarse en un nuevo elemento, tienen el potencial de superar esta irreversibilidad al modificar la dinámica del sistema completo.
Además, se ha observado que los procesos de desarrollo están llenos de efectos pleiotrópicos y relaciones jerárquicas, lo que hace improbable que la carga se acumule de manera gradual y lineal en caracteres individuales. También se ha criticado la clasificación de carga debido a que los caracteres no están claramente vinculados de manera causal, ya que la dinámica de la morfogénesis no es lineal y se basa en una red compleja de relaciones causa-efecto que involucran tanto la regulación genética como la epigenética de los mecanismos morfogenéticos. Estas dos críticas, relacionadas con la pleiotropía y la falta de un vínculo causal claro, representan algunas de las objeciones más significativas al concepto de carga en su formulación original.
Más allá de estas críticas, el concepto de carga en evo-devo es fundamental porque describe cómo la estructura y organización de un organismo (su plan corporal o Bauplan) y los procesos de desarrollo (o morfogénesis) están interconectados y limitan las innovaciones evolutivas posibles.
Por un lado, podemos entender la carga como la influencia que ejerce la morfogénesis en la organización del plan corporal. Durante el desarrollo embrionario, los procesos morfogenéticos siguen un orden preciso que da forma a estructuras esenciales. Este orden y secuencia actúan como restricciones que limitan cambios grandes en el plan corporal. Es decir, la manera en que se construyen las partes del organismo establece límites sobre cómo puede evolucionar su forma general.
Por otro lado, la organización del Bauplan también limita la morfogénesis, lo que significa que el plan corporal que heredamos afecta las posibles variaciones durante el desarrollo. Si un rasgo es esencial para mantener la estructura del organismo y está muy interconectado con otros, habrá menos flexibilidad para cambiarlo sin afectar todo el sistema. Por lo tanto, cualquier innovación evolutiva deberá adaptarse a estas restricciones estructurales y funcionales.
En resumen, el concepto de carga en evo-devo resalta cómo la estructura y la forma en que se desarrolla el organismo se limitan mutuamente, lo que afecta qué tipos de nuevas características pueden aparecer y ser sostenibles en la evolución.
Lectura recomendada
Rasskin-Gutman, D., & Esteve-Altava, B. (2021). Concept of burden in evo-devo. Evolutionary developmental biology: A reference guide, 39-49.
4.2.2.4 Una perspectiva macroevolutiva de las restricciones del desarrollo
Las restricciones de desarrollo en los animales limitan de manera significativa la capacidad evolutiva para generar nuevas características morfológicas o funcionales, contribuyendo así a la estabilidad de los planes corporales a lo largo de extensos períodos evolutivos. Estas restricciones, que funcionan como un filtro en la variabilidad fenotípica, están profundamente integradas en la biología del desarrollo de los organismos multicelulares y representan una de las principales razones por las cuales ciertos caracteres tienden a mantenerse invariables en grupos taxonómicos amplios. La capacidad de cambio, o evolucionabilidad, de estos caracteres se ve limitada por el propio sistema de desarrollo, ya que cualquier cambio importante en caracteres interdependientes podría desestabilizar la estructura general del organismo.
A nivel macroevolutivo, estas restricciones de desarrollo surgen de la compleja interacción de procesos que regulan el crecimiento y la diferenciación celular en el embrión. A medida que los organismos se desarrollan, diferentes sistemas, como los tejidos y órganos en formación, deben coordinarse de manera precisa para lograr un organismo funcional. Esta coordinación genera dependencias funcionales entre las partes del organismo, creando una red de interacciones donde ciertos caracteres, al volverse muy interconectados, acumulan una carga que dificulta su cambio sin afectar a la totalidad del organismo. Esto implica que estos caracteres, aunque están sujetos a variación genética y selección natural, presentan menos flexibilidad evolutiva debido a la necesidad de preservar las interacciones que sostienen la estructura y función del organismo.
Un ejemplo importante de esta limitación es la diferenciación celular. En la mayoría de los metazoos, las células que se han especializado en una función no pueden dividirse para regenerarse. Esto se debe a que los componentes celulares necesarios para la división son incompatibles con los que permiten la diferenciación, como los cilios en células especializadas. Este límite en la proliferación de células diferenciadas implica que muchos animales no cuentan con células madre pluripotentes en la etapa adulta, lo que restringe su capacidad de regeneración y reparación de tejidos, especialmente en órganos complejos.
Las restricciones de desarrollo también afectan la capacidad para evolucionar nuevas estructuras o formas de reproducción. La partenogénesis, o reproducción asexual, es un ejemplo de esto en animales complejos. Para que un embrión pueda desarrollarse sin fertilización, ciertos elementos paternos, como el centrosoma, son necesarios para la correcta organización del desarrollo. Además, la restauración de la ploidía en partenogénesis enfrenta problemas derivados de la meiosis y su alta interactividad, lo que eleva las probabilidades de efectos pleiotrópicos negativos, es decir, efectos no deseados derivados de la influencia de un solo gen sobre múltiples rasgos.
Otro fenómeno que ilustra estas restricciones es la conservación de etapas embrionarias críticas, como la etapa filotípica en los vertebrados, una fase intermedia del desarrollo en la que los caracteres generales del grupo ya están establecidos. En esta etapa, los sistemas en desarrollo interactúan de manera tan intensa que cualquier cambio podría tener efectos amplios y negativos. Debido a esta interdependencia, la variabilidad en la forma y función del organismo está limitada, y solo pueden surgir variaciones pequeñas y específicas sin alterar el plan corporal básico.
La pleiotropía, o el efecto de un solo gen sobre múltiples rasgos, es una de las principales fuentes de restricciones en el desarrollo. Cuando un gen influye en varios caracteres al mismo tiempo, las mutaciones en ese gen pueden generar efectos en múltiples aspectos de la anatomía o fisiología del organismo, lo que limita la flexibilidad de los caracteres controlados por ese gen. Esta interconexión dificulta la evolución de nuevas formas y funciones, ya que la modificación de un carácter puede desencadenar efectos adversos en otros caracteres relacionados.
A pesar de estas limitaciones, las restricciones de desarrollo no son absolutas. La relajación de la selección estabilizadora permite a veces superar restricciones de desarrollo, facilitando innovaciones evolutivas. Esto sucede cuando el ambiente cambia, como en la aparición de nuevos nichos o la desaparición de depredadores, lo cual está asociado a radiaciones adaptativas. Bajo selección relajada, las novedades pueden persistir el tiempo suficiente para que se reduzcan los efectos pleiotrópicos negativos, aumentando su probabilidad de mantenerse cuando la selección se intensifica nuevamente. Animales como perros domésticos, perezosos, manatíes y cetáceos muestran ejemplos de esta relajación. En perros, el cuidado humano permite la supervivencia de rasgos inusuales, mientras que en perezosos y manatíes, la baja actividad y el metabolismo lento permiten variación en el número de vértebras cervicales sin consecuencias graves. En cetáceos, el soporte del agua facilita la variación esquelética, mostrando cómo diferentes regímenes de selección influyen en la superación de restricciones evolutivas.
Lectura recomendada
Galis, F., & Metz, J. A. (2021). A macroevolutionary perspective on developmental constraints in animals. Evolutionary Developmental Biology: A Reference Guide, 51-67.
4.2.2.5 Innovación y novedad fenotípica y evo-devo
Tradicionalmente, la teoría evolutiva se ha centrado en entender cómo se modifican las estructuras ya existentes a través de la variación y la adaptación. Sin embargo, la aparición de novedades, es decir, características que no tienen un antecedente directo en el linaje de un organismo, plantea un desafío particular. Aunque Darwin reconoció que la aparición de novedades es un problema evolutivo diferente de la adaptación, la mayoría de las discusiones sobre evolución se han orientado a incorporar estas novedades dentro del marco de la variación genética y la adaptación, y no como un fenómeno separado.
Es la evo-devo la que ha dado mayor importancia al estudio de las novedades en el contexto evolutivo, convirtiendo este tema en un área central de investigación. La evo-devo ha ampliado el debate al introducir nuevos conceptos y marcos teóricos que permiten ver las novedades desde una perspectiva de desarrollo. Esto ha dado lugar a una literatura diversa que aporta tanto ejemplos empíricos como contribuciones teóricas, aunque estos estudios varían en sus definiciones y conceptos de novedad. No existe un consenso sobre cómo deben integrarse estas ideas dentro del marco evolutivo tradicional, ya que diferentes autores emplean distintos términos y perspectivas para abordar el tema. La investigación en torno a las novedades fenotípicas es, por tanto, un campo interdisciplinario que combina aportes de biología del desarrollo, genética, ecología y teoría evolutiva.
Enmarcar el problema de la novedad dentro de los discursos evolutivos tradicionales generalmente lleva a la exclusión completa de los argumentos basados en evo-devo. Por ejemplo, la narrativa de micro-macroevolución ha demostrado ser especialmente eficaz para minimizar la consideración del papel del desarrollo en el cambio evolutivo, utilizando la idea de que el desarrollo pertenece únicamente al ámbito macroevolutivo y, por lo tanto, no afecta el esquema considerado decisivo en la microevolución (variación genética, herencia y selección natural). Incluir el problema de la novedad en el discurso de la plasticidad fenotípica suele tener un efecto similar. Dado que la plasticidad y las normas de reacción generalmente se definen genéticamente, cualquier novedad que se derive de la plasticidad de los sistemas de desarrollo se interpreta inevitablemente como consecuencia de la variación genética y, por tanto, se integra en la ortodoxia evolutiva. Así, las capacidades reales de los sistemas de desarrollo no tienen ningún papel en estos enfoques.
Para superar estas limitaciones, es necesario adoptar una perspectiva nueva que no dependa de los modelos explicativos tradicionales y que permita integrar los mecanismos de desarrollo de generación de novedades en el marco evolutivo. Esto implica observar los tipos de resultados que ha producido la evo-devo y cómo estos iluminan el problema de la novedad. Dos enfoques principales en este sentido son el estudio de los mecanismos de desarrollo que generan novedades y el uso de modelos teóricos para comprender este proceso.
Términos fundamentales como novedad e innovación, a menudo se usan indistintamente. Sin embargo, varios autores hacen distinciones específicas: la novedad suele referirse a estructuras o caracteres nuevos, mientras que la innovación describe funciones nuevas o adaptaciones importantes. Algunos estudiosos consideran que la novedad implica la aparición de estructuras completamente nuevas, mientras que la innovación se refiere a cambios en un grupo que tienen un gran impacto ecológico, como la capacidad de un organismo para explotar un nuevo nicho. En este sentido, una novedad es un nuevo carácter que se individualiza en un linaje, mientras que una innovación describe el modo en que esta novedad se convierte en una ventaja evolutiva dentro de un clado o grupo de organismos.
Además, se debe distinguir entre innovación del desarrollo e innovación evolutiva. La innovación del desarrollo se refiere a los procesos mecánicos o materiales que permiten que una novedad fenotípica se haga realidad, mientras que la innovación evolutiva describe cómo estas innovaciones se incorporan en la historia evolutiva de un linaje. Este enfoque subraya la importancia de los mecanismos de desarrollo en la generación de novedades, pero también cómo estas pueden convertirse en características evolutivas estables a lo largo del tiempo. Otro término central es innovación clave, que se refiere a “invenciones” evolutivas que permiten a un linaje invadir un nuevo nicho o zona adaptativa, facilitando radiaciones adaptativas y especiación. Estas innovaciones pueden presentarse en distintos niveles (fisiológico, morfológico, conductual) y están relacionadas tanto con la novedad como con la innovación en evo-devo. Sin embargo, la innovación clave no siempre implica una novedad en el sentido de evo-devo, ya que puede surgir de variación estándar en estructuras o funciones preexistentes.
Las explicaciones tradicionales sobre las causas de las novedades fenotípicas tienden a debatir entre la primacía de la mutación genética o del ambiente como factores iniciales. En este enfoque, las mutaciones se ven como causas directas de la variación evolutiva, mientras que el ambiente actúa como un agente que introduce oportunidades o presiones selectivas. Sin embargo, la evo-devo introduce una perspectiva diferente en la que los sistemas de desarrollo mismos tienen un rol causal principal en la aparición de novedades. En este contexto, el desarrollo no se entiende solo como un conjunto de mecanismos que implementan las variaciones causadas por mutaciones o el ambiente, sino como un factor activo que organiza y presenta la variabilidad fenotípica de una manera no aleatoria.
En el contexto de la evo-devo y el estudio de la novedad evolutiva, las condiciones iniciales y realizadoras son conceptos clave para entender cómo surgen nuevos caracteres o funciones en los organismos. Estos términos permiten una visión diferente al clásico enfoque de causas proximales (mecanismos inmediatos) y últimas (razones evolutivas). Tradicionalmente, en biología evolutiva, las causas proximales explican cómo ocurre un rasgo (los mecanismos como la regulación génica y los procesos fisiológicos), mientras que las causas últimas abordan por qué ese rasgo existe, destacando su función evolutiva y sus beneficios adaptativos en el contexto de la selección natural. Sin embargo, evo-devo subraya que el desarrollo tiene un papel activo en estos procesos, organizando la variabilidad de manera coherente con la arquitectura corporal y afectando directamente las novedades evolutivas. En este contexto, las condiciones iniciales se refieren a factores que activan el potencial para la aparición de novedades: incluyen mutaciones genéticas, que introducen nuevas variantes en el ADN; la selección natural, que favorece ciertos caracteres según el entorno; y los factores ambientales, como el surgimiento de nuevos nichos ecológicos, que generan oportunidades o limitaciones. Estos elementos crean la posibilidad de novedades evolutivas, pero no definen cómo se expresarán en el organismo. Por su parte, las condiciones realizadoras representan los procesos específicos que concretan estas potenciales novedades en rasgos fenotípicos durante el desarrollo. Aquí, el desarrollo actúa como una “causa eficiente” que define el resultado fenotípico de la innovación. Los mecanismos de desarrollo moldean la expresión génica a través de redes reguladoras y señales celulares, organizan las variaciones en patrones estructurales o funcionales que producen nuevas estructuras adaptadas y, finalmente, integran el rasgo de manera coherente con la estructura corporal del organismo, de forma no aleatoria. Este enfoque destaca al desarrollo como un agente activo en la evolución que no solo implementa variabilidad genética, sino que estructura y dirige la aparición de novedades fenotípicas, vinculando las condiciones iniciales al fenotipo del organismo en un proceso que va más allá de las explicaciones evolutivas tradicionales.
4.2.2.5.1 Definiciones y clasificaciones
El estudio de la novedad en evolución comienza por definir claramente qué es la novedad y cómo distinguirla de otros tipos de cambio evolutivo, como la variación o la adaptación. En biología, la novedad generalmente se refiere a un carácter que nunca ha existido en el linaje ancestral de su portador, marcando así una diferenciación que se relaciona con el concepto de homología. La homología permite reconocer estas novedades como entidades discretas, robustas y heredables, lo que facilita su clasificación en el contexto evolutivo. Algunos autores han definido la novedad en función de cambios cualitativos y transiciones entre picos adaptativos en el paisaje de aptitud, en lugar de solo cambios cuantitativos.
Existen diferentes clasificaciones para las novedades morfológicas con categorías total o parcialmente solapantes. Una tipología integradora de todas éstas distinguiría tres tipos principales: (1) Novedades constitutivas, como los planes corporales primarios surgidos con la multicelularidad, (2) Novedades discretizantes, que son nuevos elementos estructurales en un plan corporal existente sin equivalentes homólogos en ancestros, y (3) Novedades individualizantes, que implican la modificación de elementos existentes para adquirir una nueva calidad o capacidad funcional. Esta clasificación permite identificar de manera fiable diferentes clases de novedades morfológicas, como los cambios en planes corporales multicelulares iniciales, la aparición de nuevas estructuras como corazones alares en insectos o elementos de especialización como las formas de los picos en los pinzones de Darwin.
Los mecanismos de evo-devo que intervienen en la formación de estas novedades son diversos y abarcan tanto procesos de desarrollo como interacciones químico-físicas entre células y tejidos. Las novedades constitutivas, por ejemplo, establecen la infraestructura morfológica básica que sostiene las demás innovaciones, como la aparición de células huevo y las primeras estructuras multicelulares. Las novedades discretizantes surgen de interacciones complejas en el desarrollo, donde la reorganización de circuitos de regulación genética y rutinas de desarrollo celulares resulta en la creación de estructuras sin equivalentes en especies ancestrales. Las novedades individualizantes derivan de la variación de mecanismos de desarrollo más convencionales, llevando los elementos estructurales preexistentes a nuevos niveles de especialización y variabilidad, permitiendo que surjan formas especializadas y extremas de estructuras conocidas. Esta diferenciación de la novedad en varios tipos y el enfoque en la morfología permiten clasificar mejor los tipos de novedades fenotípicas que surgen en la evolución y muestran que la formación de novedades no está restringida a un solo mecanismo de evo-devo, sino que involucra una variedad de procesos de desarrollo y evolución interrelacionados.
4.2.2.5.2 Innovación en el desarrollo
La innovación en el desarrollo examina cómo las interacciones complejas entre genes, células, tejidos, el organismo completo y su entorno contribuyen a la formación de novedades evolutivas. El desarrollo no es un proceso lineal; implica una red de retroalimentaciones entre estos niveles, donde cualquier cambio en un componente puede generar efectos en toda la estructura del organismo. Esto convierte a cada proceso involucrado en una fuente potencial de innovación.
En el nivel genético, el argumento de que la mutación es el primer paso en la evolución ha sido tradicionalmente propuesto como la base para explicar la formación de novedades. Sin embargo, el énfasis ha cambiado de las mutaciones acumulativas en genes individuales hacia eventos genómicos de mayor escala que afectan el desarrollo, un enfoque que antes se veía con escepticismo bajo la metáfora de los “mounstruos esperanzados”. La duplicación de genes, la transferencia horizontal de genes y las modificaciones en redes reguladoras son eventos clave para generar novedad. Estas modificaciones genéticas permiten que ciertos genes se expresen en nuevos contextos, lo que puede originar estructuras completamente nuevas o funciones alteradas. Ejemplos incluyen la duplicación y co-opción de genes que luego son reutilizados en ubicaciones diferentes, los eventos de duplicación de genoma completo, y la alteración de rutas de desarrollo, como se observa en algunos organismos multicelulares.
A nivel celular y tisular, los procesos de proliferación diferencial y de fusión entre entidades de desarrollo previamente independientes son particularmente importantes en la creación de novedades estructurales. La proliferación diferencial, que implica el crecimiento de células en ubicaciones específicas, permite que ciertas áreas se individualicen y tomen formas especializadas, como en los picos de aves, los colmillos de mamíferos, y apéndices de insectos y mamíferos como el topo de nariz estrellada. La fusión de estructuras en desarrollo también es fundamental para crear nuevas configuraciones morfológicas; por ejemplo, la formación de cuernos en escarabajos o el desarrollo del pico inferior en aves. Además, los procesos de compartimentalización y separación son otra vía clave para generar nuevas estructuras en regiones de desarrollo previamente uniformes. La diferenciación de elementos seriales, como en el patrón de las alas de las mariposas o en las compartimentalizaciones en la cabeza de los vertebrados, ilustra cómo la reorganización espacial puede originar patrones y estructuras completamente nuevos. Cambios relativos en regiones inductivas también pueden provocar diferenciaciones novedosas, como el desarrollo de bolsas internas forradas de pelaje en roedores o cambios en la división mesodérmica lateral en la formación de brotes en las extremidades de vertebrados. Las restricciones espaciales durante el desarrollo también son potentes disparadores de novedades; por ejemplo, los “corazones” de las alas en insectos surgen como consecuencia de cambios espaciales asociados a la reorganización del aparato de vuelo.
Otro componente clave en la innovación se basa en las conductas emergentes de sistemas multicomponentes y multiescala. En los sistemas de desarrollo, las interacciones a nivel molecular, celular, tisular y de órgano generan conductas emergentes que producen patrones fenotípicos sin intervención directa de factores externos específicos. Estos incluyen la agregación celular, la estratificación de tejidos y la formación de cavidades, que dependen de mecanismos estocásticos, sistemas de reacción-difusión y procesos de señalización tanto de corto como de largo alcance. Un ejemplo destacado es la formación de dígitos en las extremidades de vertebrados, que ocurre mediante agregación celular en el primordio en crecimiento de la extremidad.
La química y física del desarrollo también informan cada vez más sobre cómo se generan las novedades. Propiedades celulares como la adhesividad, elasticidad, y transducción mecánica crean vínculos mecanísticos entre cambios genéticos y manifestaciones fenotípicas. En los tejidos mecanosensibles, como aquellos implicados en la formación de hueso, la transducción de señales mecánicas puede influir en la expresión génica y en las respuestas tisulares. La compresión o tensión, por ejemplo, puede desencadenar la formación de nuevas estructuras en las mandíbulas de anuros, serpientes y peces. En estos últimos, las familias Cichlidae y Labridae han desarrollado independientemente nuevas articulaciones debido a este tipo de factores.
Este enfoque evo-devo muestra cómo las innovaciones evolutivas surgen de la combinación de variabilidad genética y mecanismos de desarrollo que movilizan conductas autónomas en células y tejidos, produciendo efectos no lineales y retroalimentaciones multiescalares. Estas retroalimentaciones incrementan la complejidad de los procesos involucrados en la novedad morfológica, y la modelización teórica se convierte en una herramienta valiosa para comprender estos fenómenos. La continua variación en los procesos genéticos y de desarrollo puede llevar a efectos emergentes y a nuevas estructuras morfológicas, ilustrando cómo el desarrollo es un agente activo en la evolución que ayuda a integrar y estabilizar características novedosas a lo largo del tiempo.
4.2.2.5.3 Modos de formación de las novedades
Los modelos de formación de novedades evolutivas abarcan desde simulaciones computacionales hasta métodos cualitativos, permitiendo analizar cómo interactúan los genes, células y tejidos para originar nuevas estructuras. Un enfoque importante en estos modelos es el concepto de morfoespacio, que representa las limitaciones de los sistemas de desarrollo para producir solo un número limitado de soluciones fenotípicas. Parece claro que la variación de estructuras fenotípicas simples tiende a ser gradual, mientras que la variación de fenotipos complejos se caracteriza por formas de cambio y tasas de innovación más puntuadas o abruptas. La complejidad también influye en los patrones de la tasa de innovación, promoviendo aceleraciones tempranas y desaceleraciones tardías en un clado. Estos aspectos han motivado una recategorización de los tipos de formación de patrones de desarrollo en función de su capacidad para producir novedades morfológicas, distinguiendo entre modos de desarrollo morfostáticos y morfodinámicos.
En los mecanismos morfodinámicos, las etapas temporales del desarrollo afectan el curso de la morfogénesis, mientras que los morfostáticos dependen de interacciones génicas más deterministas, lo que estabiliza ciertos fenotipos y limita su variación. Esta distinción explica cómo algunas estructuras permanecen estables mientras que otras se modifican gradualmente.La formación de patrones combinatorios en la multicelularidad temprana muestra que ciertos genes básicos permitieron que células individuales en organismos multicelulares se organizaran en patrones que dieron lugar a configuraciones corporales iniciales como esferas, formas alargadas y segmentos. Este modelo sugiere que las primeras formas multicelulares eran plásticas y dependientes del ambiente, evolucionando luego hacia configuraciones estables a medida que la selección estabilizadora consolidaba las formas heredables.
Existen modelos que exploran la formación de novedades inducidas por el ambiente, particularmente a través del estrés que puede inducir la diferenciación de nuevos tipos celulares. El estrés facilita la expresión de variación genética que normalmente no tendría efecto fenotípico, lo que a su vez permite la integración y adaptación de innovaciones a largo plazo en respuesta a desafíos ambientales mediante asimilación genética.
Finalmente, el modelo de innovación del desarrollo (o epigenético según otros autores) relaciona los diferentes modos de introducción de novedades con las formas estándar de variación y la selección estabilizante. Según este enfoque, las fases de introducción de novedades se alternan con fases de variación cuantitativa, es decir, fases donde se expresan variaciones en características ya existentes.
Novedades constitutivas: Estas surgen temprano en la evolución permitiendo formar las primeras estructuras básicas del organismo. Tras su aparición, estas novedades pasan por múltiples ciclos de variación y selección, que estabilizan las estructuras rudimentarias del cuerpo.
Novedades discretizantes: Estas emergen cuando el sistema de desarrollo alcanza su límite para controlar o “amortiguar” variaciones. En este punto crítico, o umbral, el sistema permite la formación de un núcleo de rasgos completamente nuevos, que pueden ser viables en algunas ocasiones y contener potencial adaptativo. Este núcleo es luego afinado y adaptado en rondas sucesivas de selección, convirtiéndose en un rasgo definido y funcional en el organismo.
Novedades individualizantes: Este tipo de novedad surge de formas extremas de variación continua, donde elementos de la estructura preexistente se especializan o individualizan de manera única, como sucede con las formas especializadas de ciertos órganos o estructuras anatómicas.
Este modelo sugiere que la evolución de la complejidad en los organismos es resultado de la interacción constante entre la formación de novedades, la variación continua y la selección, lo cual lleva a que las novedades se refinen y estabilicen a lo largo del tiempo.
4.2.2.5.4 Teoría de la innovación
La evo-devo proporciona herramientas para estudiar la innovación en biología y en otros campos, destacando la importancia del desarrollo en la aparición de novedades evolutivas. Si bien se ha intentado crear teorías generales de la novedad, los factores complejos y dinámicos implicados hacen difícil aplicar un modelo único a todos los dominios evolutivos.
A diferencia de la visión ortodoxa, que considera la selección natural como la única fuerza que modela los cambios fenotípicos, evo-devo sostiene que las novedades dependen solo indirectamente de la selección. En este enfoque, la selección natural libera el potencial generativo de los sistemas de desarrollo, pero la especificidad de los rasgos depende principalmente de las propiedades dinámicas y materiales del desarrollo en sí mismo. Esto coloca el foco en las causas internas del desarrollo y no solo en factores externos. Este enfoque es capturado en el concepto de inherencia, que se refiere a la capacidad intrínseca de los sistemas de desarrollo para generar rasgos fenotípicos, independientemente de si el impulso inicial proviene de mutaciones, selección o estímulos ambientales.
La evo-devo también se centra en la organización más que en la simple optimización de rasgos. Esto contrasta con el enfoque poblacional tradicional, donde la variación genética y la selección natural son suficientes para explicar la evolución fenotípica. La evo-devo integra principios generativos, como la organización celular, la modularidad y comportamientos físicos inherentes, ampliando la teoría evolutiva más allá de los fenómenos poblacionales y proporcionando un marco teórico para predecir cómo se forman novedades fenotípicas.
La plasticidad del desarrollo es esencial para la innovación evolutiva, especialmente para las novedades individualizantes. Aunque la plasticidad y su base genética contribuyen a otros tipos de formación de novedades, evo-devo va más allá de la plasticidad, priorizando los factores generativos del desarrollo sobre la variación genética como explicación de la evolución fenotípica.
Evo-devo reestructura el marco de la evolución, complementando el estudio de la evolución genética con principios generativos derivados de la organización celular y las dinámicas del desarrollo. La teoría de la innovación del desarrollo amplía el alcance explicativo de la biología evolutiva, integrando capacidades predictivas que permiten anticipar resultados fenotípicos específicos basados en el conocimiento de los sistemas de desarrollo. Esto abre nuevas preguntas de investigación en el estudio de la innovación y la novedad fenotípica, ampliando el enfoque tradicional de la biología evolutiva.
Lectura recomendada
Müller, G. B. (2021). Developmental innovation and phenotypic novelty. Evolutionary developmental biology: A reference guide, 69-84.
4.2.2.6 Homología y evo-devo
La homología es el principio que define la “identidad” de los caracteres biológicos, determinando si dos rasgos pertenecen al mismo tipo. Por ejemplo, los ojos de humanos y aves son homólogos como ojos de vertebrados, lo que significa que comparten un origen evolutivo común. El concepto de homología, que surgió en la anatomía comparada pre-darwiniana, luego se comprendió como un fenómeno evolutivo basado en la descendencia común. Así, dos caracteres en diferentes organismos son homólogos si están conectados genealógicamente por un ancestro común que poseía ese mismo carácter.
Por ejemplo, los ojos humanos y de aves son homólogos porque todos sus ancestros compartidos, hasta el primer amniota, tenían ojos. En cambio, los ojos de humanos y de insectos no son homólogos, ya que su ancestro común no tenía ojos; su similitud se debe a la homoplasia o evolución convergente.
La homología cumple varios roles esenciales en biología:
R1. Proporciona un sistema de clasificación descriptiva para los caracteres biológicos. R2. Determina lo que se conserva en la evolución, ayudando a distinguir cambios evolutivos o novedades. R3. Facilita inferencias filogenéticas que ubican caracteres y taxones en árboles evolutivos. R4. Permite inferencias sobre posibles similitudes en la producción genética y del desarrollo de caracteres homólogos y sus tendencias de variación.
Para comprender y aplicar la homología, los investigadores necesitan criterios adicionales a la definición evolutiva básica, ya que esta no especifica cómo determinar la continuidad genealógica sin observación directa. Además, muchos caracteres solo aparecen durante una parte del ciclo de vida y pueden modificar sus características a lo largo de generaciones y especies, lo que exige identificar qué aspectos pueden cambiar sin perder la homología.
Para abordar estos desafíos, se han propuesto varios criterios de homología:
C1. Similitud en propiedades descriptivas: Caracteres con propiedades complejas similares que es poco probable que evolucionen de manera independiente. C2. Posición topológica similar: Caracteres en la misma posición relativa respecto a otros caracteres en el cuerpo. C3. Congruencia filogenética: Caracteres que encajan en un árbol filogenético y definen grupos monofiléticos. C4. Similitud en generación genética o mecanicista: Caracteres que comparten un origen genético o mecanismo de desarrollo. Los primeros dos criterios son comúnmente aceptados, mientras que los otros permiten distinguir entre dos enfoques de la homología: el enfoque filogenético o histórico, que se basa en la relación evolutiva, y el enfoque biológico o del desarrollo, centrado en los mecanismos de generación de los caracteres.
4.2.2.6.1 Enfoque filogenético y desarrollista de la homología
Los dos principales enfoques de la homología enfatizan criterios diferentes según sus objetivos de investigación. El enfoque filogenético o cladístico se centra en descubrir patrones de caracteres y taxones en el árbol de la vida, utilizando principalmente la similitud descriptiva y de posición topológica (C1 y C2) y la congruencia filogenética (C3) para identificar homologías. En este enfoque, las homologías se consideran sinapomorfías (caracteres que definen un grupo monofilético), mientras que el criterio de desarrollo (C4) puede apoyar, pero no define, la homología en este contexto.
Por otro lado, el enfoque desarrollista o biológico de la homología está orientado a explicar la conservación de caracteres fenotípicos en la evolución. Según este enfoque, los métodos filogenéticos deben complementarse con el criterio desarrollista, que establece que los caracteres son homólogos solo si comparten las mismas causas de desarrollo, como genes, vías embriológicas o redes regulatorias específicas. Este enfoque busca explicar por qué ciertos caracteres permanecen estables en el tiempo o cambian de manera específica, centrándose en los factores internos del desarrollo que restringen o estructuran la variabilidad.
La evo-devo incorpora estos enfoques en una estructura teórica más amplia, asignando un papel central a las homologías como unidades estructurales de variación fenotípica, en contraste con la teoría evolutiva neodarwiniana, que prioriza la selección como principal fuerza explicativa. La evo-devo permite generalizaciones comparativas más allá de los límites filogenéticos, gracias a recursos regulatorios conservados, como los genes Hox, que permiten entender mejor la evolución fenotípica. Con este enfoque, la homología se vuelve fundamental para la biología comparativa y adquiere un papel más relevante en la teoría evolutiva.
4.2.2.6.2 Caracteres: los relatos de la homología
La homología suele entenderse como una relación entre caracteres, pero surge la pregunta de qué define un carácter en biología. Históricamente, en la anatomía comparada del siglo XIX, la homología se aplicaba principalmente a partes anatómicas del cuerpo, como sistemas de órganos y sus componentes observables. Sin embargo, el alcance de la homología se ha expandido, incluyéndose ahora tejidos, células, organelos, genes y redes génicas, así como procesos de desarrollo, comportamientos y actividades de las partes de un organismo. La premisa general es que cualquier entidad puede ser homóloga si cumple con el criterio de descendencia común.
Los enfoques sistemáticos y cladísticos de la homología mantienen esta visión amplia, pero añaden una restricción práctica: los caracteres homólogos deben ser identificables y útiles para definir grupos monofiléticos en un análisis cladístico. En general, las características estructurales son mejores para este propósito, ya que son más estables a lo largo del ciclo de vida y pueden dejar huellas fósiles.
El enfoque desarrollista es más selectivo en cuanto a qué puede considerarse un carácter homólogo. Según esta perspectiva, los caracteres verdaderos deben estar “individualizados a nivel de desarrollo”, lo que significa que deben poseer un módulo regulador específico que controle su desarrollo y limite su variación. Aquellas características que no cumplen con esta individualización, como los pseudo-caracteres y los estados de carácter, no se consideran caracteres genuinos. Los pseudo-caracteres son aquellos que surgen únicamente como subproductos de la interacción, proximidad o superposición entre caracteres individualizados. Por ejemplo, el mentón humano es una protuberancia ósea derivada de un subproducto del crecimiento mandibular y, desde la perspectiva desarrollista, no es un carácter individualizado.Los estados de carácter incluyen propiedades como el tamaño o color de un rasgo. Ambos tipos de “no-caracteres” carecen de la característica clave de independencia variacional en el proceso de evolución del desarrollo y se espera que sean mucho más inestables evolutivamente que los caracteres individualizados.
Otra diferencia entre los enfoques sobre el tema de los caracteres es que la relación filogenética entre caracteres puede diferir de la similitud desarrollista o mecanicista, especialmente al comparar un carácter ancestral con uno altamente derivado. Por ejemplo, la notable homología entre la articulación mandibular de los reptiles y los osículos del oído de los mamíferos representa una relación de transformación filogenética, pero estos caracteres no son homólogos ni iguales desde un punto de vista de desarrollo o mecánico.
4.2.2.6.3 Homología serial y especial
En los enfoques clásicos, como el de Richard Owen, la homología no solo se consideraba como una relación entre caracteres en diferentes organismos, sino también entre caracteres dentro de un mismo organismo. A esta última se la denomina homología serial o iterativa, en contraste con la homología especial entre especies. Ejemplos de homología serial incluyen las vértebras en la columna vertebral, segmentos corporales en insectos y órganos simétricos en pares como los riñones y los ojos.
Los criterios para identificar homologías seriales son la similitud descriptiva y la similitud genética o mecánica en su generación, mientras que el criterio topológico y los métodos filogenéticos no son aplicables. La homología serial permite explorar la repetición de caracteres dentro de un organismo, pero no ayuda a inferencias filogenéticas, lo cual limita su uso en el análisis cladístico.
Desde la perspectiva filogenética, la homología serial no se considera homología genuina, pues no permite establecer congruencia filogenética. Sin embargo, los defensores de un enfoque desarrollista ven esta falta de definición filogenética como una limitación del enfoque filogenético. Argumentan que los caracteres repetidos dentro de un organismo son importantes para entender la evolución, especialmente en el caso de la duplicación y diversificación de caracteres, que contribuyen a la complejidad y especialización funcional.
La controversia gira en torno a si la homología serial y especial deberían regirse por la misma definición. Aunque mantener distintas definiciones para la homología serial y especial podría simplificar el debate, el problema sigue abierto debido a la pregunta de si ambos tipos de homología cumplen roles similares en la evolución del desarrollo.
4.2.2.6.4 Homología, homoplasia, paralelismo y homología profunda
La homología se entiende tradicionalmente como el determinante de la similitud de caracteres, en contraste con conceptos como la homoplasia y el paralelismo. La homoplasia es la similitud entre caracteres debida a una evolución convergente y no a un origen común, mientras que el paralelismo ocurre cuando caracteres evolucionan de manera independiente pero comparten una base de desarrollo homóloga, diferenciándolo de la convergencia verdadera. Aunque los conceptos de homología, homoplasia y paralelismo están bien definidos teóricamente, en la práctica pueden ser difíciles de distinguir debido a la complejidad de los sistemas biológicos.
Las redes de genes reguladores, responsables del desarrollo de los caracteres, suelen presentar interacciones complejas, lo cual plantea preguntas sobre cuántos elementos en común deben compartir para considerarse homólogos. Algunos autores sugieren que la homología en redes de desarrollo puede ser parcial, lo que implica que los caracteres también podrían ser parcialmente homólogos, parcialmente paralelos o incluso parcialmente homoplásticos, lo que difumina las distinciones clásicas entre estos conceptos.
Un descubrimiento relevante de la genética del desarrollo es la homología profunda, que se refiere a la presencia de genes y circuitos reguladores similares en grupos taxonómicos muy diferentes, como los genes que regulan el desarrollo ocular en insectos y vertebrados. Aunque las estructuras finales, como los ojos de insectos y vertebrados, no son homólogos, sí comparten una base genética común. La homología profunda indica que muchas estructuras fenotípicas no necesariamente requieren cambios genéticos completamente nuevos, sino la reutilización de circuitos reguladores preexistentes, lo que explica la rapidez con la que pueden surgir novedades evolutivas adaptativas. Este fenómeno de homología profunda plantea preguntas sobre la homología y la novedad en la evolución, ya que algunos caracteres aparentemente nuevos pueden derivar de modificaciones de estructuras preexistentes. También sugiere que la convergencia podría haber sido sobreestimada y que el paralelismo sería más común de lo que se pensaba, lo que podría implicar que el desarrollo juega un papel más fuerte y la selección uno más débil en la evolución de los patrones fenotípicos.
4.2.2.6.5 Desafíos y perspectivas
El estudio de la homología enfrenta el reto de integrar las perspectivas filogenética y de desarrollo. Aunque estas enfoques tienen metas científicas distintas, su relación es más una interdependencia que una separación estricta. Las aproximaciones filogenéticas pueden beneficiarse de las consideraciones del desarrollo, ya que el estudio ontogenético puede ayudar a determinar el origen o la “polaridad” de las transformaciones de caracteres. Por su parte, la perspectiva filogenética aporta un contexto histórico necesario para rastrear la continuidad de los caracteres y evaluar cómo estos cambian o se mantienen a través de linajes evolutivos, sugiriendo una relación de mutuo beneficio entre ambas perspectivas.
Un desafío específico en el enfoque del desarrollo es lograr una correspondencia directa entre las causas de desarrollo y los caracteres fenotípicos. La variación conocida como “deriva del sistema de desarrollo” (DSD) presenta problemas para modelos genéticos de homología en los que un mismo carácter puede tener diferentes bases genéticas. Este fenómeno muestra que la identidad de un carácter no siempre reside en genes específicos, y plantea que la homología morfológica podría no depender de la homología en niveles inferiores de organización.
La homología plantea preguntas filosóficas clave sobre cómo definir y diferenciar caracteres en biología, abordando temas como la clasificación biológica, la individuación de caracteres, y el pluralismo explicativo. Los biólogos buscan identificar caracteres “iguales” a pesar de las variaciones evolutivas, lo que dificulta encontrar una definición universal y práctica de homología. Un enfoque pluralista sugiere que la homología podría determinarse por distintas combinaciones de factores según el contexto. Sin embargo, este enfoque debe ser suficientemente claro y aplicable para permitir juicios consistentes sobre homología en estudios biológicos, considerando los roles biológicos principales de la homología (R1-R4) y ajustándose a contextos específicos donde los criterios tradicionales (C1-C4) pueden fallar.
Lectura recomendada
DiFrisco, J. (2021). Developmental homology. Evolutionary developmental biology: A reference guide, 85-97.
4.2.2.7 Deriva del sistema de desarrollo
Los caracteres homólogos reflejan una ascendencia común entre taxones relacionados. Si un rasgo se mantiene invariable en un grupo específico, se infiere que no ha cambiado a lo largo de las líneas de descendencia. Por ejemplo, los huesos radio y cúbito en las extremidades anteriores de los tetrápodos son homólogos. Sin embargo, los caracteres morfológicos son productos de rutas de desarrollo cuya estabilidad en los mecanismos genéticos subyacentes no siempre es tan firme como se asume. Para evo-devo, esta suposición permite estudiar la novedad fenotípica sin preocuparnos de cambios en los rasgos conservados. Para la investigación biomédica, sugiere que los hallazgos en organismos modelo son aplicables a los humanos. Sin embargo, esta estabilidad en el desarrollo de rasgos homólogos puede no ser siempre correcta.
Los rasgos conservados pueden divergir en sus bases genéticas de desarrollo a lo largo del tiempo evolutivo. Este concepto fue articulado independientemente por dos grupos de investigación diferentes, dándole el nombre de “deriva del sistema de desarrollo” (DSD, developmental system drift) y “deriva fenogenética”, respectivamente, aunque su noción general tiene sus origenes en mediados del siglo XX. El concepto moderno sugiere que las redes genéticas que regulan el desarrollo pueden cambiar siempre que el resultado sea viable.
Esta noción está relacionada con la evolución de las incompatibilidades Bateson–Dobzhansky–Muller (BDMIs), en las cuales las sustituciones alélicas, limitadas a linajes aislados (y bien toleradas en ellos), generan incompatibilidades que pueden manifestarse en híbridos. Sin embargo, el DSD es distinto, ya que puede implicar la introducción y pérdida de elementos genéticos o de interacciones entre ellos. Este tipo de cambios probablemente tarda más en ocurrir que las BDMIs de cambio gen por gen. En términos más prácticos, el DSD suele inferirse al perturbar el desarrollo en organismos que están demasiado divergidos como para hibridarse, pero que conservan rasgos homólogos. Además, es crucial distinguir el DSD de la deriva genética aleatoria, donde las frecuencias alélicas cambian por azar debido a errores de muestreo entre generaciones, afectando a cualquier tipo de alelo en función del tamaño poblacional. El DSD, en cambio, ocurre bajo selección estabilizadora, lo que indica que los genes implicados están sometidos a selección natural continua. Sin embargo, la deriva genética aleatoria podría contribuir al DSD cuando ciertos tipos de variación son seleccionados en líneas divergentes.
4.2.2.7.1 Evidecias de la deriva del sistema de desarrollo
Las evidencias de DSD provienen de estudios en varios niveles, desde la hibridación entre especies hasta comparaciones genéticas detalladas.
Híbridos de Especies: En especies cercanas que pueden cruzarse, la hibridación a menudo revela defectos en el desarrollo de rasgos que normalmente son idénticos en ambas especies parentales. Un ejemplo claro es el híbrido entre las moscas Drosophila melanogaster y Drosophila simulans, donde los híbridos pueden carecer de cerdas que sí están presentes en las especies puras. Esta ausencia se debe a la incompatibilidad entre variantes alélicas específicas de cada especie que afectan la red génica responsable del desarrollo de cerdas. Este tipo de observación llevó a los investigadores a formular la idea de DSD, ya que sugiere que las redes de desarrollo pueden divergir incluso bajo selección estabilizadora.
Evidencia Embriológica: Comparaciones del desarrollo embrionario entre diferentes especies también ilustran el DSD. Un ejemplo es el desarrollo de los dedos (autopodios) en tetrápodos. Mientras que los dedos de las salamandras se desarrollan en un sentido anterior-primero (preaxial), el desarrollo en otros tetrápodos sigue un patrón posterior-primero (postaxial). Esta divergencia en el desarrollo, aunque no cambia la estructura final, parece estar vinculada a la capacidad única de las salamandras para regenerar sus autopodios en la edad adulta. Otro caso se encuentra en los nemátodos, donde a pesar de su anatomía simple, muestran grandes diferencias en sus etapas embrionarias, incluyendo variaciones en la formación de las células fundadoras y en los movimientos morfogenéticos esenciales, como la formación del intestino durante la gastrulación.
Perturbación Genética y Celular en Caenorhabditis: Las investigaciones en nemátodos del género Caenorhabditis, especialmente en C. elegans y C. briggsae, han sido clave para caracterizar el DSD. Estos organismos transparentes y bien documentados genéticamente han permitido observar cómo los genes de desarrollo mantienen patrones de expresión constantes incluso cuando los elementos reguladores divergen. Experimentos de interferencia de ARN (RNAi) han demostrado que, aunque dos especies comparten genes ortólogos, sus efectos fenotípicos pueden diferir significativamente. Por ejemplo, al inactivar ciertos genes en C. briggsae, el efecto en el fenotipo es más débil que en C. elegans, revelando diferencias en la red de interacción genética que subyacen a los mismos rasgos. Esto sugiere que la evolución puede modificar tanto la expresión de genes como sus redes de interacción sin alterar la estructura final del organismo.
Variabilidad Críptica en el Desarrollo de la Vulva de Nematodos: Estudios comparativos en el desarrollo de la vulva en especies como Caenorhabditis y Pristionchus han revelado tanto diferencias evidentes como variaciones ocultas en las señales intercelulares que guían su formación. Aunque ambas especies utilizan los mismos genes clave para desarrollar la vulva, la organización y la respuesta a estas señales varía. Estas diferencias, que no afectan la apariencia final de la estructura, solo se revelan cuando se manipulan experimentalmente, como al alterar señales o eliminar células. Además, incluso dentro de una sola especie, como en distintas cepas de C. elegans, existen variaciones en la intensidad de las señales que afectan el desarrollo vulvar.
Estos ejemplos de DSD resaltan cómo las redes genéticas y mecanismos de desarrollo pueden experimentar modificaciones complejas sin afectar el resultado fenotípico final. Este proceso de cambio en los sistemas de desarrollo estabilizados proporciona una vía para la diversidad evolutiva y la adaptación sin comprometer la integridad funcional del organismo, y demuestra que la estabilidad de un rasgo no implica una estabilidad genética o de desarrollo subyacente.
4.2.2.7.2 Mecanismos de la deriva del sistema de desarrollo
Los mecanismos teóricos de la Deriva del Sistema de Desarrollo (DSD) incluyen:
Duplicación y Subfuncionalización de Genes (Fig. 4.16A): Cuando un gen se duplica, se crean dos copias que inicialmente realizan la misma función. Con el tiempo, en distintas líneas evolutivas, cada copia puede asumir partes específicas de la función original, proceso conocido como subfuncionalización. Así, la regulación de los genes objetivo se ajusta de manera diferente en cada especie, aunque el producto final (como una estructura o un rasgo morfológico) siga siendo el mismo. Esto permite que las vías de desarrollo diverjan entre especies sin cambiar el resultado observable.
Evolución Compensatoria (Fig. 4.16B): Este mecanismo se relaciona con cómo se equilibran los cambios en una vía de desarrollo. Por ejemplo, si una vía de señalización tiene redundancia (varias señales pueden activar la misma respuesta), diferentes especies pueden depender más de una señal que de otra. La evolución compensatoria (via cambios en la importancia relativa de cada señal) permite que estos sistemas redundantes diverjan entre especies, ya que ajustes en una señal pueden ser compensados por cambios en la otra.
Adaptación que Promueve DSD (Fig. 4.16C): A veces, la DSD se acelera debido a adaptaciones en otros rasgos que comparten componentes reguladores. Por ejemplo, cuando un gen pleiotrópico (uno que afecta múltiples características) está bajo selección para cambiar un rasgo, su influencia en otro rasgo estable puede ajustarse a través de cambios compensatorios. Simulaciones sugieren que si un rasgo está bajo selección direccional y otro bajo selección estabilizadora, la evolución puede adaptar el promotor del gen estabilizado para equilibrar los efectos en ambos rasgos, llevando a DSD.
Estos mecanismos muestran que la DSD no es solo un proceso pasivo, sino que puede ser influido por adaptaciones en rasgos cercanos, lo que permite divergencias en las redes de desarrollo incluso cuando el fenotipo final se conserva.
Figura 4.16: Tres mecanismos de evolución de la Deriva del Sistema de Desarrollo (DSD): (A) DSD mediante subfuncionalización de loci reguladores. Originalmente, un locus regulador codifica una proteína que controla la transcripción de los loci A y B, uniéndose a un sitio presente en los promotores de ambos. Con el tiempo, el locus regulador se duplica en los loci α y β, y cada uno evoluciona interacciones específicas: α se convierte en el regulador de A y β en el de B. (B) DSD en la determinación del destino celular mediante señales redundantes. Este mecanismo implica dos vías de señalización que inducen a una célula objetivo (enmarcada) a diferenciarse en un tipo celular específico y conservado. En el escenario central, ambas señales están equilibradas y son, al menos parcialmente, redundantes. En el escenario de la izquierda, la señal A (negra) se intensifica, permitiendo que la señal B (gris) disminuya sin afectar el fenotipo. En el de la derecha, ocurre lo contrario. En ambos casos, la vía menor podría perderse completamente, generando una notable divergencia DSD. (C) DSD en el modelo de vía ramificada. Originalmente, un locus regulador controla la expresión de los loci A y B, cada uno con un promotor (gris) que se une a la proteína reguladora con la misma afinidad, alcanzando niveles óptimos de expresión para ambos genes. Luego, la selección direccional aumenta la expresión del locus A, lo que implica cambios en el promotor de A (de gris a blanco) y en la proteína reguladora (de diamante a óvalo). Simultáneamente, la selección estabilizadora actúa sobre el locus B, requiriendo ajustes compensatorios, que ocurren mediante cambios en el promotor de B (de gris a negro). Este proceso causa DSD en la regulación de B. Factores inhibidores adicionales pueden también ser reclutados, intensificando la DSD en el locus B. Imagen tomada de Haag & True (2021).
4.2.2.7.3 Implicadiones de la deriva del sistema de desarrollo
La deriva del sistema de desarrollo (DSD) plantea desafíos y oportunidades importantes en la biología evolutiva y el estudio de la homología. Al analizar cómo las vías de desarrollo pueden variar incluso en caracteres aparentemente estables, la DSD desafía supuestos tradicionales sobre la conservación del desarrollo y ofrece nuevas perspectivas sobre la evolución de la forma y la función. Esta sección explora las implicaciones de la DSD para la biología evolutiva del desarrollo, la inferencia filogenética, la conservación funcional de genes y su impacto en la investigación biomédica, destacando cómo esta variabilidad en el desarrollo influye en la comprensión de la evolución y en el uso de modelos animales en ciencia aplicada.
Biología del Desarrollo Evolutivo: La DSD plantea un desafío para la biología del desarrollo evolutivo, cuya meta es entender cómo evolucionan las nuevas formas. Esta disciplina asume que los rasgos que no están evolucionando conservarán sus especificaciones de desarrollo, permitiendo centrarse en la aparición de novedades fenotípicas. Sin embargo, la DSD muestra que las vías de desarrollo responsables de rasgos estables pueden variar significativamente entre especies, lo cual implica que los caminos de desarrollo que sostienen caracteres conservados están en constante cambio.
Homología Biológica e Inferencia Filogenética: La homología es fundamental para reconstruir la evolución de los rasgos, y los métodos filogenéticos ayudan a identificar patrones evolutivos. Sin embargo, la DSD implica que las diferencias en la especificación del desarrollo no necesariamente niegan la homología de un rasgo. En lugar de enfocarse en la función de genes individuales, es preferible examinar “redes de identidad de caracteres” que engloban la especificación general del carácter a través de sus redes regulatorias, ayudando así a reconocer la homología a pesar de las diferencias en el desarrollo.
DSD como Hipótesis Nula para la Conservación: En biología molecular, la hipótesis nula establece que cualquier cambio en las secuencias es neutral hasta que se demuestre lo contrario. En el contexto de la DSD, la neutralidad se puede extender a nivel de sistemas de desarrollo: si las comparaciones entre sistemas revelan diferencias, estas podrían considerarse cambios sin importancia adaptativa antes de asumir una función evolutiva específica. Esto permite evaluar si las diferencias en el desarrollo son producto de la deriva neutral o reflejan adaptaciones.
Conservación Funcional de Genes: Experimentos de conservación funcional han mostrado que secuencias homólogas pueden conservar sus roles bioquímicos a lo largo de la evolución, pero la DSD implica que el contexto de la red genética puede cambiar aunque el gen se conserve. Por ejemplo, en los nematodos, el gen GLD-1 tiene una función bioquímica similar en dos especies diferentes, pero desempeña roles opuestos en la determinación sexual. Esto demuestra que, aunque un gen sea funcionalmente equivalente en distintos organismos, su impacto fenotípico puede variar debido a la reconfiguración de las redes donde actúa.
Bases Genéticas de la Evolución Convergente: La DSD permite que rasgos convergentes evolucionen a partir de configuraciones genéticas alternativas, es decir, diferentes configuraciones de genes y redes pueden producir un mismo rasgo fenotípico conservado. Esta variabilidad sugiere que, aunque la evolución puede generar adaptaciones similares en especies distintas, las rutas de desarrollo que llevan a esos resultados pueden diferir. Sin embargo, el grado exacto en el que los mecanismos genéticos congruentes sustentan un rasgo evolutivo convergente está limitado tanto por el conjunto relativamente pequeño de genes “toolkit” que regulan el desarrollo en numerosos tejidos distintos, como por la cercanía en la ascendencia de las líneas evolutivas que están convergiendo. Convergencias en especies cercanas frecuentemente se dan por el mismo mecanismo.
Investigación Biomédica: La DSD tiene implicaciones significativas en biomedicina, donde los modelos animales se emplean para estudiar aspectos de la biología humana. Aunque organismos cercanos a los humanos, como los ratones, ofrecen modelos más precisos debido a su parentesco, la DSD sugiere que incluso en modelos de mamíferos pueden existir incongruencias en los detalles genéticos que alteren los resultados de los estudios en humanos. Esto subraya la necesidad de ser cautelosos al traducir hallazgos de modelos animales a aplicaciones médicas y recalca que ignorar la DSD podría llevar a resultados fallidos o mal interpretados en la investigación biomédica.
Lectura recomendada
Haag, E. S., & True, J. R. (2021). Developmental system drift. Evolutionary developmental biology: a reference guide, 99-110.
4.2.2.8 El “reloj de arena del desarrollo” en la evolución de la embriogénesis
La embriogénesis es el proceso mediante el cual una célula fertilizada se divide y se diferencia para formar un embrión maduro. En metazoos que se reproducen sexualmente, comienza con la fertilización del óvulo por un espermatozoide, generando una célula diploide llamada cigoto. Este cigoto se somete a divisiones mitóticas sin crecimiento significativo, seguido por la gastrulación, en la que las células se diferencian y se establecen los ejes y el plan corporal básico. Luego, durante la organogénesis, se desarrollan y organizan los órganos a lo largo de estos ejes, culminando en un embrión multicelular y maduro.
Desde el siglo XIX, el vínculo entre la evolución y el desarrollo embrionario ha sido objeto de debate. Las primeras teorías de recapitulación, como las de Meckel y Serres, sostenían que el desarrollo embrionario de un organismo (ontogenia) recapitulaba las etapas evolutivas de la especie (filogenia), idea popularizada por Ernst Haeckel en su máxima “la ontogenia recapitula la filogenia”. Según esta teoría, los embriones de animales más complejos pasarían por etapas que representan formas adultas de animales menos complejos. Por ejemplo, los embriones humanos en etapas tempranas muestran estructuras que se asemejan a las branquias, lo cual se interpretaba como un reflejo de etapas evolutivas anteriores, similares a los peces.
El embriólogo alemán del siglo XIX Karl Ernst von Baer (1792–1876) reformuló las teorías de recapitulación. Observó que existían sorprendentes similitudes morfológicas entre especies animales del mismo filo durante ciertos periodos de su desarrollo embrionario. En lugar de recapitular las formas adultas de otros animales, von Baer propuso que los embriones animales divergen a partir de una o pocas formas embrionarias compartidas. Según su hipótesis, las etapas de desarrollo en animales más complejos nunca representan las etapas adultas de animales menos complejos; en cambio, se asemejan a los embriones de estos animales menos complejos. Von Baer también observó que los embriones de animales de filos relacionados a menudo se ven morfológicamente distintos en las primeras etapas de la embriogénesis, convergen hacia una forma similar durante la etapa media de embriogénesis y luego divergen nuevamente en las etapas finales de desarrollo.
Esta observación llevó a la formulación del modelo de reloj de arena en el desarrollo embrionario, según el cual las etapas iniciales y finales de la embriogénesis son divergentes entre especies, mientras que las etapas medias presentan una mayor similitud morfológica, conocida como el “periodo filotípico”. Durante este periodo intermedio, los embriones de un mismo filo se parecen más entre sí, antes de volver a diferenciarse en etapas más avanzadas. Este modelo de reloj de arena, propuesto independientemente por Elinson, Duboule y Raff, nos ayuda a comprender mejor las relaciones entre evolución y desarrollo embrionario al sugerir que las etapas medias del desarrollo son altamente conservadas evolutivamente, lo cual tiene implicaciones importantes para el estudio de la biología evolutiva del desarrollo.
4.2.2.8.1 El modelo de reloj de arena del desarrollo embrionario
El modelo de reloj de arena se formuló originalmente a partir de observaciones morfológicas del desarrollo embrionario. Este modelo divide la embriogénesis en tres etapas: temprana, media y tardía. La etapa temprana abarca las divisiones mitóticas del cigoto, la gastrulación y el establecimiento de los ejes corporales y dominios generales de la forma adulta, mostrando una gran variación entre especies dentro de un filo (representando la base ancha del reloj de arena). La etapa media, denominada como el periodo o etapa filotípica, es cuando ocurre la organogénesis y el plan corporal final se establece, mostrando la máxima similitud entre especies de un filo (el punto estrecho del reloj de arena). En la etapa tardía, el plan corporal se desarrolla hasta reflejar la forma adulta, aumentando la variación entre especies y ampliando la parte superior del reloj de arena (Fig. 4.17).
Figura 4.17: El modelo de reloj de arena del desarrollo embrionario describe cómo los procesos de desarrollo se conservan durante la evolución. Según el modelo, la máxima conservación dentro de un filo ocurre durante la etapa filotípica media, mientras que las etapas tempranas y tardías muestran mayores diferencias. Imagen tomada de Cridge et al. (2021).
Inicialmente, este modelo fue objeto de controversia debido a las dificultades de usar características morfológicas para evaluar cuantitativamente la relación entre variación y conservación en cada etapa del desarrollo. Los estudios que buscaban identificar etapas de desarrollo sensibles a mutaciones también enfrentaron obstáculos debido a la complejidad de los mecanismos de los teratógenos empleados en los estudios. Sin embargo, con el avance de la transcriptómica comparativa, a través de análisis de RNA-seq, se ha podido apoyar cuantitativamente el modelo de reloj de arena.
Los estudios transcriptómicos han abordado la conservación de la expresión génica en etapas embrionarias de dos maneras. Primero, comparaciones basadas en distancia han mostrado que la expresión génica ortóloga es más conservada durante la etapa filotípica y menos en las etapas temprana y tardía. La segunda, mediante índices transcriptómicos, indica que la etapa filotípica expresa los genes más antiguos evolutivamente, mientras que las etapas temprana y tardía expresan genes más jóvenes. En conjunto, estos estudios moleculares confirman que la expresión génica en la etapa filotípica media es más conservada que en las etapas temprana y tardía, respaldando el patrón de reloj de arena en la evolución del desarrollo embrionario.
4.2.2.8.2 El modelo de reloj de arena y la evolución de la embriogénesis
El modelo de reloj de arena en la embriogénesis ayuda a entender cómo los procesos de desarrollo y las restricciones evolutivas interactúan durante la evolución de los organismos. Este modelo describe una estructura donde el desarrollo embrionario pasa por tres fases principales: una fase temprana con mayor variabilidad, una fase media altamente conservada y una fase tardía con creciente diversidad entre especies. Este patrón ha sido identificado no solo en animales, sino también en plantas con flores, lo cual sugiere que podría ser un caso de evolución convergente, debido a restricciones evolutivas que favorecen una conservación en la fase media de la embriogénesis.
Durante el desarrollo embrionario, las redes reguladoras de genes son fundamentales para coordinar la formación del plan corporal. Estas redes están compuestas por interacciones complejas que controlan la activación secuencial de genes, desde las señales maternas iniciales hasta los genes zigóticos responsables de los ejes principales del cuerpo y el desarrollo de los tejidos y órganos. En conjunto, estas interacciones genéticas forman una red jerárquica de desarrollo en la que subredes específicas controlan el desarrollo de diferentes partes del cuerpo. Dado que estas redes reguladoras son tan complejas, cualquier perturbación en ellas puede resultar en cambios fenotípicos drásticos y, en algunos casos, en la inviabilidad del embrión. Así, la evolución de la embriogénesis requiere un equilibrio entre la conservación de estas redes esenciales para el plan corporal y la capacidad de generar nuevas rutas de desarrollo que permitan la aparición de formas o funciones novedosas.
La fase temprana de la embriogénesis se caracteriza por la formación de las capas germinales y los ejes principales del embrión. En esta fase, los patrones de desarrollo muestran una mayor diversidad tanto a nivel morfológico como en la expresión genética, lo cual sugiere que el desarrollo temprano ha estado menos restringido por la evolución. Las redes de genes que regulan la formación de ejes en esta fase están compuestas por un número relativamente pequeño de genes, y estas interacciones han evolucionado rápidamente en algunos organismos. Por ejemplo, en insectos como Drosophila melanogaster, muchos de los genes que controlan el patrón del eje corporal no se encuentran en el genoma de otras especies de insectos o han desarrollado nuevas interacciones reguladoras. Esto indica que, mientras las redes genéticas necesarias para establecer los ejes del cuerpo continúen funcionando, es posible que la expresión, función o secuencia de los genes iniciales puedan evolucionar sin comprometer la viabilidad del embrión.
En la fase media de la embriogénesis, conocida como la etapa filotípica, el embrión desarrolla su plan corporal sobre los ejes establecidos durante la fase temprana, y se produce la organogénesis. Esta fase requiere una diferenciación precisa de células en patrones espaciales y temporales bien definidos. Las redes reguladoras de genes en esta etapa son más complejas, con factores de transcripción que se expresan en dominios bien definidos a lo largo de los ejes. Estudios moleculares han demostrado que los factores de transcripción en la fase de media embriogénesis muestran patrones de expresión conservados entre especies del mismo filo. Por ejemplo, los genes Hox, descubiertos originalmente en Drosophila, juegan un papel crucial en la identidad segmentaria a lo largo del eje anteroposterior en muchos metazoos. Estos genes han demostrado ser altamente conservados, y sus mutaciones pueden provocar alteraciones significativas en el plan corporal. Esta conservación tanto morfológica como a nivel de redes genéticas durante la fase filotípica refleja la necesidad de establecer los órganos en un patrón funcional que sustente la forma adulta. La evolución en esta fase es, por lo tanto, más restringida, ya que cualquier variación puede provocar defectos de desarrollo y pérdida de viabilidad, lo cual genera una fuerte presión de selección negativa. Este proceso contribuye a la “cintura” estrecha del modelo de reloj de arena, donde las tasas de evolución tienden a ser más bajas en comparación con las fases tempranas y tardías.
La fase tardía de la embriogénesis se caracteriza por el desarrollo final del plan corporal, donde órganos y extremidades maduran y comienzan a diferenciarse en formas adultas específicas de cada especie. En esta fase, las redes reguladoras de genes y sus expresiones muestran una mayor diversidad entre los taxa. Estudios moleculares sugieren que los genes expresados en las etapas tardías tienden a mostrar mayores divergencias de secuencia en comparación con genes más conservados y son evolutivamente más recientes. Estas diferencias en la expresión genética son menos pleiotrópicas, ya que se relacionan principalmente con detalles morfológicos específicos de cada especie en lugar de con los elementos estructurales fundamentales del cuerpo. Esto significa que las alteraciones en esta fase son menos críticas y permiten la acción de la selección positiva, que da forma a la variabilidad de acuerdo con las necesidades ecológicas. En conjunto, la combinación de restricciones pleiotrópicas reducidas y presión de selección positiva favorece una mayor tasa de evolución en esta fase, lo cual explica la expansión característica del reloj de arena en las últimas etapas del desarrollo embrionario.
El modelo de reloj de arena, por tanto, ilustra cómo las diferentes fases del desarrollo embrionario están sujetas a restricciones evolutivas variables. Esto proporciona una comprensión profunda de la relación entre la evolución y la embriogénesis, demostrando cómo las limitaciones en las redes reguladoras de genes y las presiones selectivas moldean el desarrollo y la variabilidad de las formas en las especies.
Lectura recomendada
Cridge, A. G., Dearden, P. K., & Brownfield, L. R. (2021). The developmental hourglass in the evolution of embryogenesis. Evolutionary Developmental Biology: A Reference Guide, 111-120.
4.2.2.9 Inherencia
Este concepto explora la idea de que las formas biológicas no son infinitamente variables y adaptables, sino que están limitadas y son predecibles, lo cual desafía la teoría evolutiva convencional que prioriza la selección natural como principal moldeadora de la morfología. En otras ciencias, se acepta que la variabilidad de las formas está confinada dentro de ciertos límites. Por ejemplo, los copos de nieve, aunque todos son únicos, siempre presentan una simetría de seis puntas debido a la estructura cristalina del hielo. De manera similar, el agua líquida tiene restricciones inherentes que determinan sus formas posibles, como ondas y remolinos.
Un caso comparativo es la tabla periódica de los elementos: los protones, neutrones y electrones pueden formar alrededor de un centenar de átomos estables, pero todos dentro de un rango específico de propiedades. Estos elementos no aparecieron todos al inicio del universo, sino que “evolucionaron” conforme las condiciones permitieron su formación, mostrando que, aunque las formas sean inherentes a ciertos tipos de materia, su aparición puede tener una historia gradual.
La diferencia entre la teoría de la evolución por selección natural y el entendimiento científico de la estructura de la materia se relaciona con la época en que surgieron las ideas modernas sobre la evolución. En el siglo XIX, aún no existía una comprensión física de materiales complejos, incluyendo los tejidos vivos y los embriones, que hoy día se estudian bajo la física de mesoescala. Este campo emergente, integrado en la biología evolutiva del desarrollo (evo-devo), sugiere que hay factores intrínsecos y predecibles en la estructura y evolución de los organismos multicelulares.
Aunque la síntesis evolutiva moderna (MES) y la síntesis evolutiva extendida (EES) han ampliado el enfoque evolutivo, incluyendo la autoorganización y el desarrollo constructivo, aún no abordan plenamente la idea de que muchas características fundamentales de los animales y plantas son inherentes y, en cierta medida, inevitables.
4.2.2.9.1 Plasticidad, genes de gran efecto y sesgo del desarrollo
El objetivo principal de la teoría de Darwin y Wallace y sus sucesoras ha sido explicar la diversidad de formas y funciones de los organismos. En este contexto, el concepto de selección natural postula que, dado que la reproducción biológica es imperfecta y las condiciones externas siempre están cambiando, los organismos pueden evolucionar si aquellos con características que los adapten mejor a su ambiente contribuyen más a las generaciones futuras. A diferencia de otras teorías científicas, que buscan predecir, la síntesis evolutiva moderna (MES) no define resultados fenotípicos prederminados o deterministas. Esta teoría asume que casi cualquier cosa es posible en la evolución, siempre que haya tiempo suficiente.
Un elemento clave en la MES es que las variaciones en el ADN son aleatorias en cuanto a sus efectos fenotípicos, lo cual es fundamental para la selección natural. Sin embargo, la síntesis evolutiva extendida (EES) reconoce que las variaciones no siempre son aleatorias; en cambio, pueden estar sesgadas, sugiriendo que los organismos tienen una inclinación natural hacia ciertos cambios. A lo largo de la historia, conceptos como el lamarckismo (herencia de características adquiridas), el saltacionismo (cambios fenotípicos abruptos) y la ortogénesis (evolución guiada por fuerzas internas) fueron descartados, aunque algunos de sus elementos han sido reconsiderados en décadas recientes.
El saltacionismo, por ejemplo, se ha reevaluado. Aunque la MES favorece cambios graduales, existen ejemplos de cambios abruptos, como epimutaciones y mutaciones en genes reguladores, que pueden provocar transformaciones fenotípicas significativas en una sola generación. Esto desafía la idea de que solo cambios pequeños y graduales pueden generar adaptaciones.
Asimismo, el concepto de “sesgo de desarrollo” (o “restricción de desarrollo”) ha ganado atención en el contexto de la EES. Estudios comparativos en embriología han mostrado que existen patrones de desarrollo que limitan las formas posibles, y a veces el espacio morfológico (morphospace) no está ocupado no por falta de adaptación, sino porque ciertas estructuras son inviable mecánicamente. Aunque la MES ignoró estas limitaciones, la EES incorpora estos conceptos, sugiriendo que las reglas del desarrollo tienen un papel en la evolución.
A pesar de estas ampliaciones en el discurso evolutivo, la biología evolutiva contemporánea aún carece de herramientas conceptuales para entender plenamente cómo fenómenos como el sesgo de desarrollo afectan la evolución. Esto representa un desafío continuo en la integración de la EES con la MES para construir una teoría evolutiva más completa.
4.2.2.9.2 La inherenia no es una extensión de la Síntesis moderna
La biología evolutiva del desarrollo (evo-devo) surgió a finales del siglo XX a partir de varios descubrimientos convergentes: (i) las transformaciones en los procesos de desarrollo pueden generar innovaciones evolutivas, (ii) la macroevolución no se explica simplemente por ciclos de cambio genético, y (iii) los organismos poseen una organización inherente, observable incluso en “monstruos” o formas sin función adaptativa pero con orden estructural como Alberch argumentó. Algunas corrientes en evo-devo reconocen estas ideas mientras mantienen la selección natural como base principal para la aparición de la forma biológica. Otras posturas, sin embargo, sostienen que los motivos estructurales clave en los planes corporales de animales y plantas son manifestaciones de las propiedades materiales de los organismos multicelulares, sugiriendo que estos patrones estructurales son en gran medida inherentes y predecibles. Desde esta perspectiva, la selección natural tendría un papel limitado, actuando solo para seleccionar entre variantes cuantitativas de formas inherentes, mientras que muchas estructuras serían “morfologías neutrales” en cuanto a la adaptación.
Los defensores de la síntesis evolutiva moderna (MES) cuestionan esta postura argumentando que la complejidad surge mediante pequeñas variaciones adaptativas acumuladas. Sin embargo, los defensores de la síntesis evolutiva extendida (EES) responden que las variaciones no siempre son pequeñas, aleatorias o adaptativas; a veces son producto de interacciones con el entorno. Aunque la EES enfatiza fuentes ampliadas de variación, sigue considerando la adaptación como motor evolutivo principal.
La idea de “inherencia” en evo-devo invierte el reto de la adaptación: los organismos encuentran formas de sobrevivir independientemente de cómo adquirieron sus rasgos. Evidencia de esto se observa en especies invasoras, especies nuevas formadas por hibridación, o nuevos morfotipos generados por la introducción de un solo gen. En estos casos, las formas surgen de manera desconectada de ciclos de adaptación, y persisten porque los organismos logran utilizarlas o porque no representan una carga.
Si factores como la selección natural o la variación facilitada no explican por completo por qué los organismos tienen las formas que tienen, entonces ¿qué lo hace? Aquí, la física de los materiales a escala media (mesoescala) ofrece respuestas, mostrando que la estructura de los organismos podría estar en gran parte determinada por sus propiedades materiales, más que por la adaptación estricta.
4.2.2.9.3 Una breve historia de las formas inherentes
Tanto los animales como las plantas han evolucionado con propiedades morfogenéticas intrínsecas que los han llevado a desarrollar una variedad restringida de patrones morfológicos específicos de cada grupo a lo largo de sus trayectorias evolutivas independientes. Este fenómeno, que se conoce en ambas ramas, es particularmente ilustrativo en el caso de los animales, y su estudio actual nos brinda una visión más profunda de las formas inherentes que estos organismos desarrollan (Fig. 4.18).
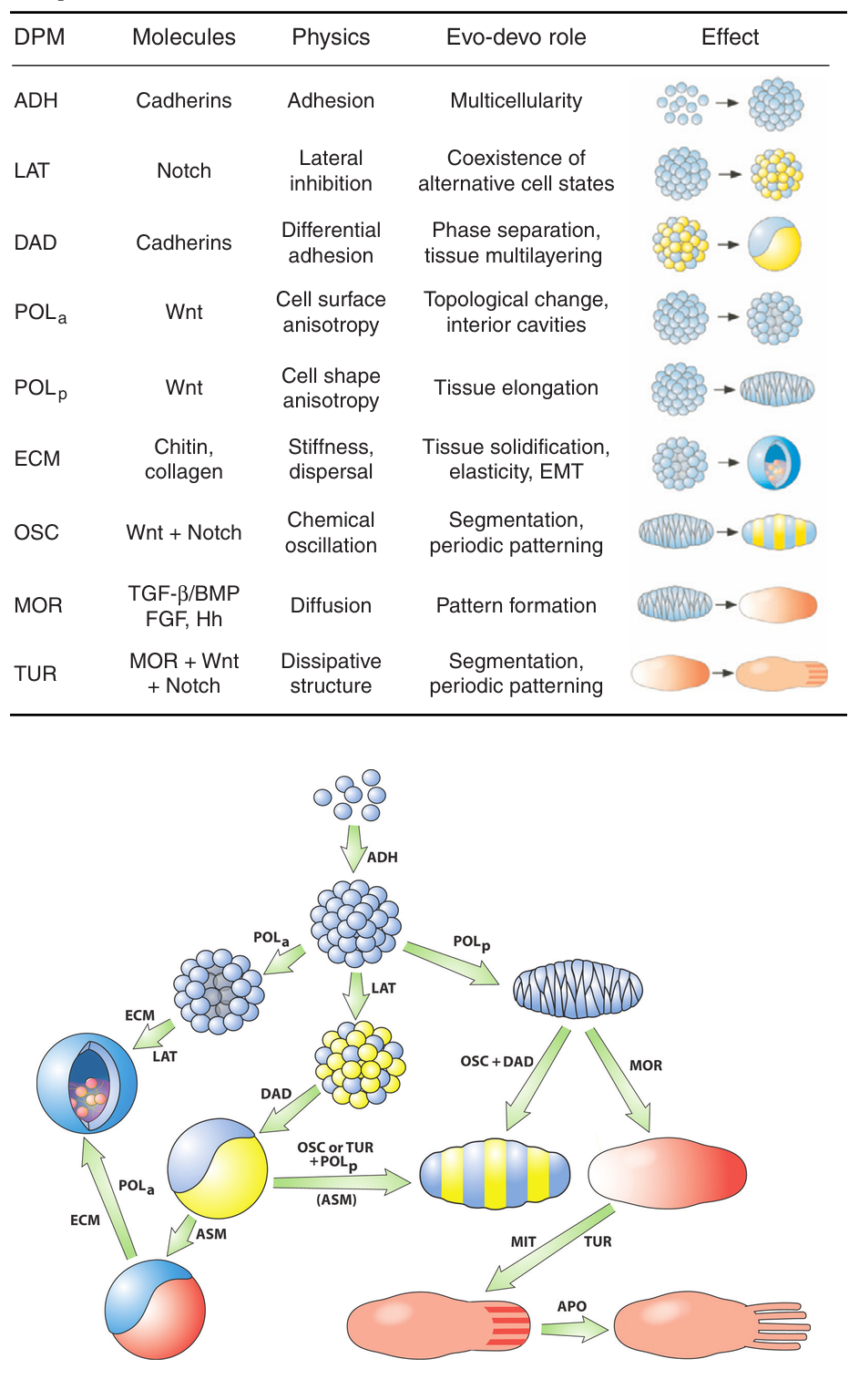
Figura 4.18: Módulos de patrón dinámico clave (DPM, dyanamical patterning modules), sus respectivos componentes moleculares y principios físicos, roles en la evolución y el desarrollo, y representaciones esquemáticas. Por DPMs nos referimos a un conjunto de moléculas producidas en un grupo de células, junto con uno o más efectos físicos activados por estas moléculas para generar un aspecto o cambio en la forma o patrón del grupo. En términos generales, ‘forma’ incluye la estructura, tamaño y topología, mientras que ‘patrón’ se refiere a la disposición específica de los tipos celulares. Abajo tenemos una representación esquemática de las formas de metazoos potencialmente generadas por la acción individual y combinada de módulos de patrón dinámico (DPM). En las filas superiores, las células se representan individualmente, mientras que las filas media e inferior muestran agrupaciones a escala de tejidos. Comenzando desde arriba, las células individuales forman agregados gracias al módulo de adhesión (ADH, por ejemplo, cadherinas, lectinas). El módulo de polaridad (POL) tiene dos versiones: polaridad apical-basal (POLa) y polaridad planar (POLp). POLa genera células con propiedades diferentes en extremos opuestos, lo que produce láminas epiteliales polarizadas y lúmenes dentro de los agregados celulares. POLp, en cambio, causa el alargamiento y entrelazamiento de las células en el plano, resultando en una extensión convergente y alargamiento de la masa celular. El módulo de inhibición lateral (LAT, vía Notch) transforma un agregado de células homotípicas en uno con dos o más tipos celulares coexistentes. Diferentes niveles de expresión de moléculas ADH conducen a la separación por adhesión diferencial (DAD). La producción de moléculas difusibles que afectan a las mismas células que las secretan genera gradientes de morfógenos (MOR, p.ej., TGF-β/BMP, hedgehog), mientras que los morfógenos también pueden actuar de forma inductiva y asimétrica (ASM, p.ej., FGFs) afectando un tipo de tejido desde otro. La oscilación bioquímica sincrónica (OSC) de componentes de las vías Notch y Wnt, junto con el módulo DAD, puede generar segmentos, siendo este mecanismo particularmente efectivo cuando se incluye el módulo ASM. Relaciones de retroalimentación entre morfógenos activadores e inhibidores pueden formar patrones con elementos repetitivos mediante procesos de reacción-difusión tipo Turing (TUR). La acción de la vía de señalización MAPK en agregados multicelulares con gradientes de morfógenos conduce al crecimiento no uniforme mediante el módulo de mitogénesis (MIT), mientras que el módulo de apoptosis (APO) provoca pérdida celular diferencial. Finalmente, la secreción de matriz extracelular (ECM, como colágeno y fibronectina) entre células o en espacios tisulares crea nuevos microambientes, facilitando la translocación celular o generando propiedades mecánicas novedosas en láminas o masas celulares.Imágenes tomadas de Newman y Bhat (2008, 2009).
Los animales, o metazoos, surgieron hace aproximadamente 700 millones de años a partir de poblaciones de células conocidas como holozoos, que también dieron lugar a los coanoflagelados unicelulares actuales. En los metazoos modernos, la cohesión celular está mediada por proteínas de adhesión de la familia de las cadherinas. Estas cadherinas permiten que las células permanezcan unidas mientras se desplazan unas sobre otras, lo que confiere a los tejidos animales propiedades parecidas a las de los líquidos. Gracias a esta cohesión celular, los tejidos animales se comportan de manera similar a los líquidos, adaptándose y organizándose en estructuras esféricas o gotas, que se convierten en la forma predeterminada de los embriones y de los tejidos en formación.
Además de las cadherinas, otro componente clave en la evolución de los eumetazoos fue el desarrollo de la matriz extracelular (MEC) basal, conocida como lámina basal. Esta estructura, que está ausente en los animales más primitivos como las esponjas, permite la formación de tejidos epiteliales verdaderos. La lámina basal funciona como una especie de lámina elástica que sostiene y organiza los tejidos. Gracias a esta estructura, los eumetazoos pudieron desarrollar un mayor rango de formas, como apéndices, tentáculos, pliegues y crestas, esenciales para sus planes corporales.
Con el tiempo, los animales triploblásticos —aquellos con tres capas embrionarias— desarrollaron una mayor complejidad morfológica. La aparición de una tercera capa embrionaria entre las dos capas epiteliales permitió la formación de tejidos mesenquimáticos, que son tejidos conectivos que facilitan la interacción entre capas y que carecen de la cohesión de los epitelios. El mesénquima se comporta como un material viscoelástico y puede dar lugar a condensaciones celulares, donde grupos de células se agrupan temporalmente, lo que es fundamental en la formación de estructuras como apéndices y órganos complejos. Esto explica por qué los animales triploblásticos poseen planes corporales más sofisticados y órganos verdaderos en comparación con los diploblásticos.
La complejidad de los tejidos triploblásticos permite que se desarrollen patrones geométricos regulares en los arreglos celulares. Estos patrones, conocidos como procesos de formación de patrones, son inherentes a estos tejidos y surgen de manera espontánea. Por ejemplo, en el desarrollo de los vertebrados, ciertos circuitos genéticos tienen una tendencia a oscilar en el tiempo, lo que permite que grupos de células se sincronicen y formen somitas, las unidades segmentadas a lo largo del eje corporal. Esta segmentación axial, que se produce de forma emergente, no depende de la selección específica para cada detalle, sino que es una propiedad inherente de los tejidos complejos (Fig. 4.19).
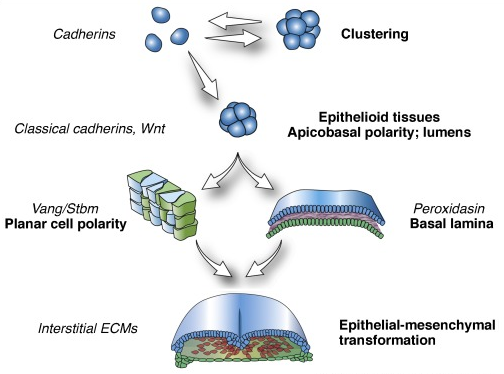
Figura 4.19: Principales transiciones morfológicas en la historia temprana de los animales, mediadas por la adquisición de propiedades líquidas y cristalinas líquidas, así como de sustratos internos y los motivos morfológicos inherentes asociados. Imagen tomada de Newman (2019).
Un ejemplo de inherencia en el desarrollo evolutivo de los vertebrados es el proceso que determina la organización esquelética de las extremidades (Fig. 4.20). En este contexto, los elementos esqueléticos no dependen de un sistema específico de información posicional, sino que surgen de la auto-organización inherente del tejido precartilaginoso. Durante el desarrollo, el tejido con propiedades de autoactivación local e inhibición lateral (LALI) forma patrones modulares de cartílago bajo la influencia de un gradiente de factor de crecimiento de fibroblastos (FGF), emanado desde la cresta ectodérmica apical (AER). Este sistema de regulación chondrogénico tiene una fuerte propensión inherente a generar estructuras óseas en forma de extremidad. El modelo computacional simula este mecanismo, prediciendo patrones normales de esqueleto, variaciones experimentales y análogos de formas tempranas fósiles, todo a partir de propiedades inherentes del sistema de desarrollo, sin requerir adaptaciones específicas o información posicional externa.
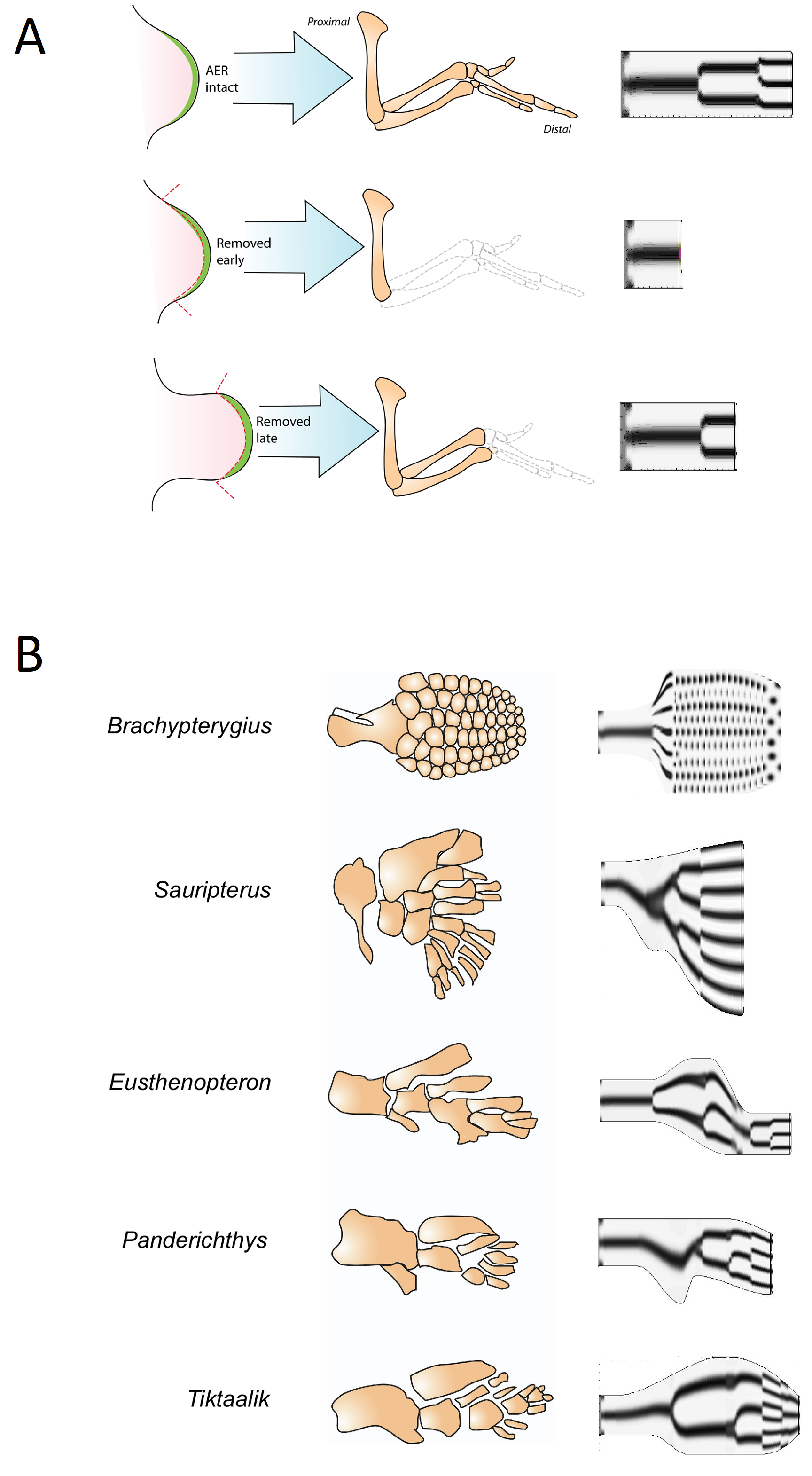
Figura 4.20: (A) Simulaciones de la eliminación de la AER. (Primeras dos columnas de la izquierda) Dibujos de experimentos de eliminación de la AER. Las imágenes superiores muestran un brote de ala de pollo intacto en una etapa temprana de desarrollo y el esqueleto de la extremidad que genera. Las imágenes del medio muestran un brote de ala en la misma etapa temprana con la AER eliminada, y el esqueleto resultante de la extremidad, que alcanza un tamaño normal pero se trunca a partir del codo. Las imágenes inferiores muestran un brote de ala en una etapa más avanzada, donde se ha eliminado la AER. El esqueleto resultante se trunca desde la muñeca en adelante. (Columna derecha) Simulaciones del desarrollo de la extremidad utilizando parámetros estándar. Arriba: AER (es decir, la fuente del morfógeno FGF supresor) intacta; el desarrollo normal resulta. Medio: AER eliminada al inicio de la simulación. Abajo: AER eliminada en una etapa posterior de la simulación. Todas las extremidades simuladas se permitieron desarrollar durante el mismo tiempo. (B) Simulación de esqueletos de extremidades fósiles. A la izquierda se muestran patrones de esqueletos de extremidades de especímenes fósiles. Mediante escenarios de desarrollo hipotéticos, se simularon los estados finales de dos peces con aletas lobuladas, Sauripterus y Eusthenopteron, y dos formas de transición entre estos organismos y los anfibios, Panderichthys y Tiktaalik, que se muestran a la derecha. Imágenes tomadas de Zhu et al. (2010).
Otro proceso que contribuye a la generación de patrones en los animales es el modelo de reacción-difusión de Turing, que ayuda a explicar la aparición de estructuras periódicas, como las rayas en la piel de los peces o los folículos pilosos en mamíferos. Este modelo emplea mecanismos básicos de biosíntesis y comunicación celular que, cuando están bien ajustados, generan estructuras repetitivas en el tejido. Estos patrones no son el resultado de una evolución adaptativa directa, sino de la interacción inherente de las células y moléculas dentro del tejido.
En resumen, los patrones y estructuras que caracterizan a los animales no son únicamente el resultado de la selección natural. La teoría de la biología evolutiva del desarrollo (evo-devo) propone que estas formas están determinadas por las propiedades físicas y bioquímicas inherentes a la biología multicelular, que limitan y orientan la evolución de los organismos. En este sentido, la selección natural juega un papel menos activo, seleccionando entre las variantes de formas preexistentes y cediendo protagonismo a las propiedades intrínsecas de los materiales y los tejidos que conforman a los animales.
4.2.2.9.4 Patrones de Turing
Alan Turing, un matemático británico famoso por su trabajo en criptografía e informática, también hizo contribuciones importantes a la biología teórica. Desarrolló un modelo matemático, conocido como “modelo de reacción-difusión”, para explicar cómo se forman patrones complejos en organismos vivos a partir de interacciones sencillas y fluctuaciones aleatorias. Este modelo sugiere que los patrones como manchas o rayas pueden surgir a través de la interacción de unas pocas moléculas con propiedades de activación y difusión en un tejido.
En el modelo de Turing, se proponen dos tipos de proteínas: una activadora y una inhibidora. La proteína activadora tiene la capacidad de activar tanto su propia producción como la del inhibidor, mientras que la proteína inhibidora, como su nombre indica, inhibe la activación de la proteína activadora. Si sólo consideramos la acción de estas proteínas en un punto fijo sin permitirles moverse (difusión), el sistema tiende a apagarse rápidamente: el activador activa el inhibidor, que a su vez apaga al activador.
Sin embargo, el modelo de Turing se vuelve interesante cuando permite que ambas proteínas se difundan por el tejido, es decir, que se muevan lejos de su punto de origen. Imaginemos que en un punto del tejido se activa la proteína activadora, que comienza a extenderse a las células cercanas y, al mismo tiempo, activa la proteína inhibidora. A medida que la activadora se propaga, la inhibidora también se extiende, frenando la activación en áreas alrededor de ese punto. Este equilibrio entre activación y difusión puede dar lugar a patrones circulares o anillos de activación en el tejido.
Para formar manchas, se necesitan dos elementos adicionales: primero, pequeñas fluctuaciones aleatorias en los niveles de activación del activador a lo largo del tejido, y segundo, que el activador se difunda más lentamente que el inhibidor. Cuando el activador se activa en una pequeña área, comienza a difundirse localmente, mientras que el inhibidor se propaga rápidamente a las áreas circundantes. Esto crea una especie de “campo” de inhibición alrededor de cada punto de activación, lo que impide que otras áreas cercanas activen el activador. El resultado es un patrón regular de manchas o puntos en el tejido.
Este modelo de reacción-difusión explica cómo patrones tan complejos pueden surgir de interacciones moleculares simples y ofrece una base teórica para entender la formación de estructuras naturales como las manchas de un leopardo o las rayas en ciertos peces. Además, el patrón específico que se forma puede depender de factores como el tamaño y la forma del tejido, así como de la velocidad de difusión de las moléculas involucradas. En resumen, el modelo de Turing ilustra cómo procesos físicos y químicos básicos pueden generar la sorprendente variedad de patrones que observamos en la naturaleza (Fig. 4.21).
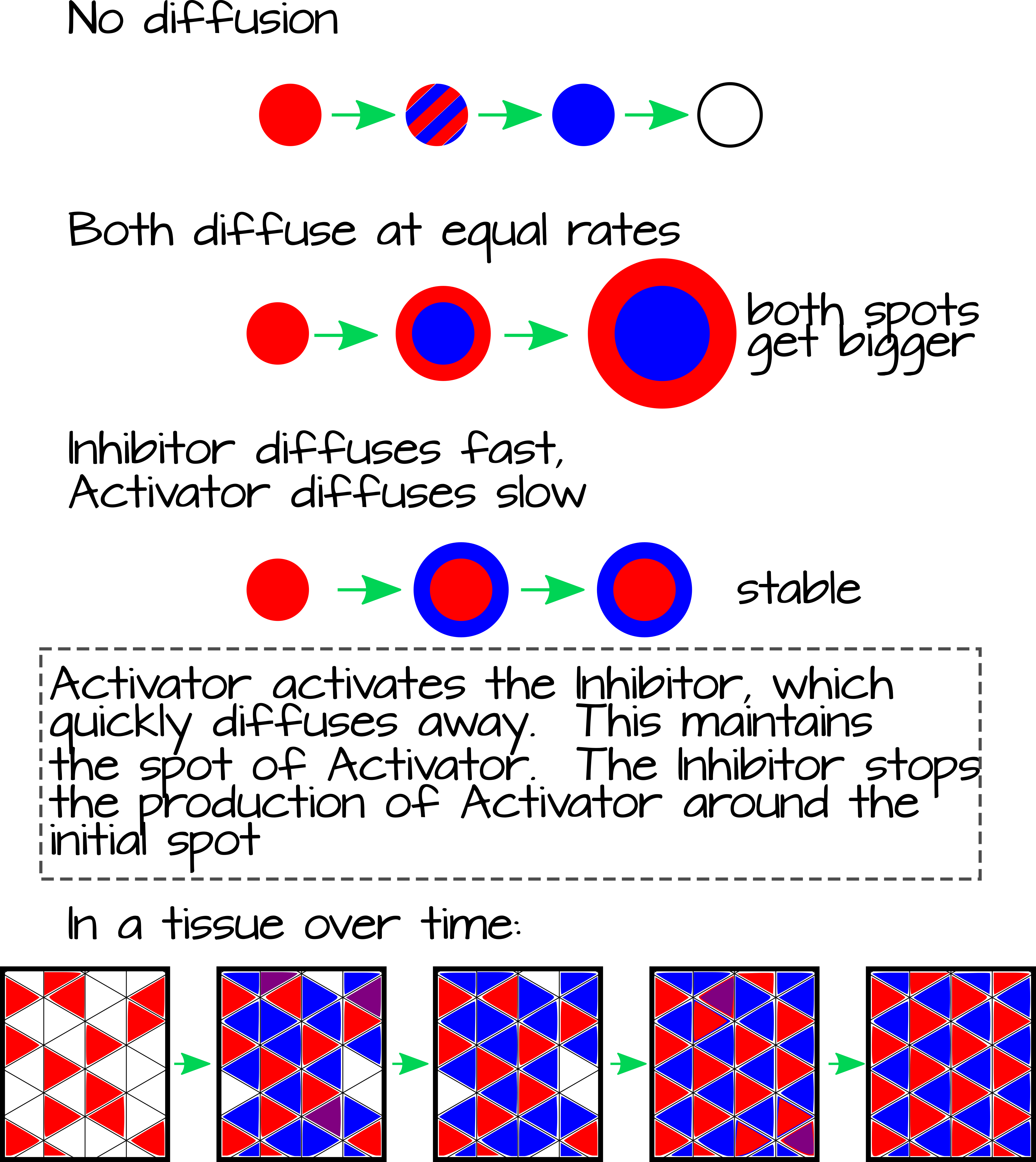
Figura 4.21: Patrones tipo Turing con un Activador (rojo) y un Inhibidor (azul). El Activador se activa a sí mismo y también activa al Inhibidor. El Inhibidor, en cambio, solo inhibe al Activador. Si el Inhibidor se difunde más rápidamente que el Activador, se puede formar un patrón regular de manchas en un tejido. En el panel inferior, el Activador se expresa aleatoriamente a niveles bajos en un subconjunto de células en un tejido. Este se autoactiva para aumentar sus niveles de expresión y, al mismo tiempo, activa al Inhibidor. El Inhibidor se difunde rápidamente hacia las células adyacentes (segundo panel). Las células que contienen tanto el Activador como el Inhibidor (púrpura) pasan rápidamente a expresar solo el Inhibidor, ya que este apaga al Activador (tercer panel). Las células que no están expuestas al Inhibidor (blancas) pueden activar el Activador aleatoriamente, lo que activa el Inhibidor difusible (cuarto panel). Así se establece rápidamente un patrón estable de células “encendidas” y “apagadas” (quinto panel). Imagen disponible bajo licencia Creative Commons CC0.
En un tejido que es largo y estrecho, la difusión de las moléculas sólo puede ocurrir en una dirección, lo que convierte el patrón de puntos propuesto por Turing en un patrón de rayas. Además, existen otros factores que pueden transformar estos patrones puntuales en franjas o rayas, como el crecimiento direccional del tejido o la presencia de un gradiente morfogénico. Se han propuesto cuatro mecanismos principales para generar un patrón de rayas (Fig. 4.22):
Difusión direccional: Cuando la difusión de las moléculas (activador e inhibidor) es más probable en una dirección específica, esto puede orientar el patrón de forma que se formen rayas en lugar de puntos.
Gradiente de producción: Este tipo de gradiente consiste en una proteína o cofactor que incrementa la producción tanto del activador como del inhibidor en un lado del tejido, lo que provoca que las franjas se orienten perpendiculares a la dirección del gradiente.
Gradiente de parámetros: Aquí, las propiedades activadoras e inhibidoras varían de un extremo del tejido al otro debido a la presencia de un gradiente de alguna proteína o cofactor. Esto hace que las franjas se orienten en paralelo a la dirección del gradiente.
Crecimiento direccional del tejido: Por ejemplo, las extremidades humanas crecen en gran medida alejándose del cuerpo (en dirección distal), lo que favorece la formación de franjas paralelas a la dirección de crecimiento. La AER (cresta ectodérmica apical) en la punta de la yema de la extremidad estimula la proliferación celular debajo de ella, lo que orienta el patrón de rayas a lo largo de la dirección del crecimiento.
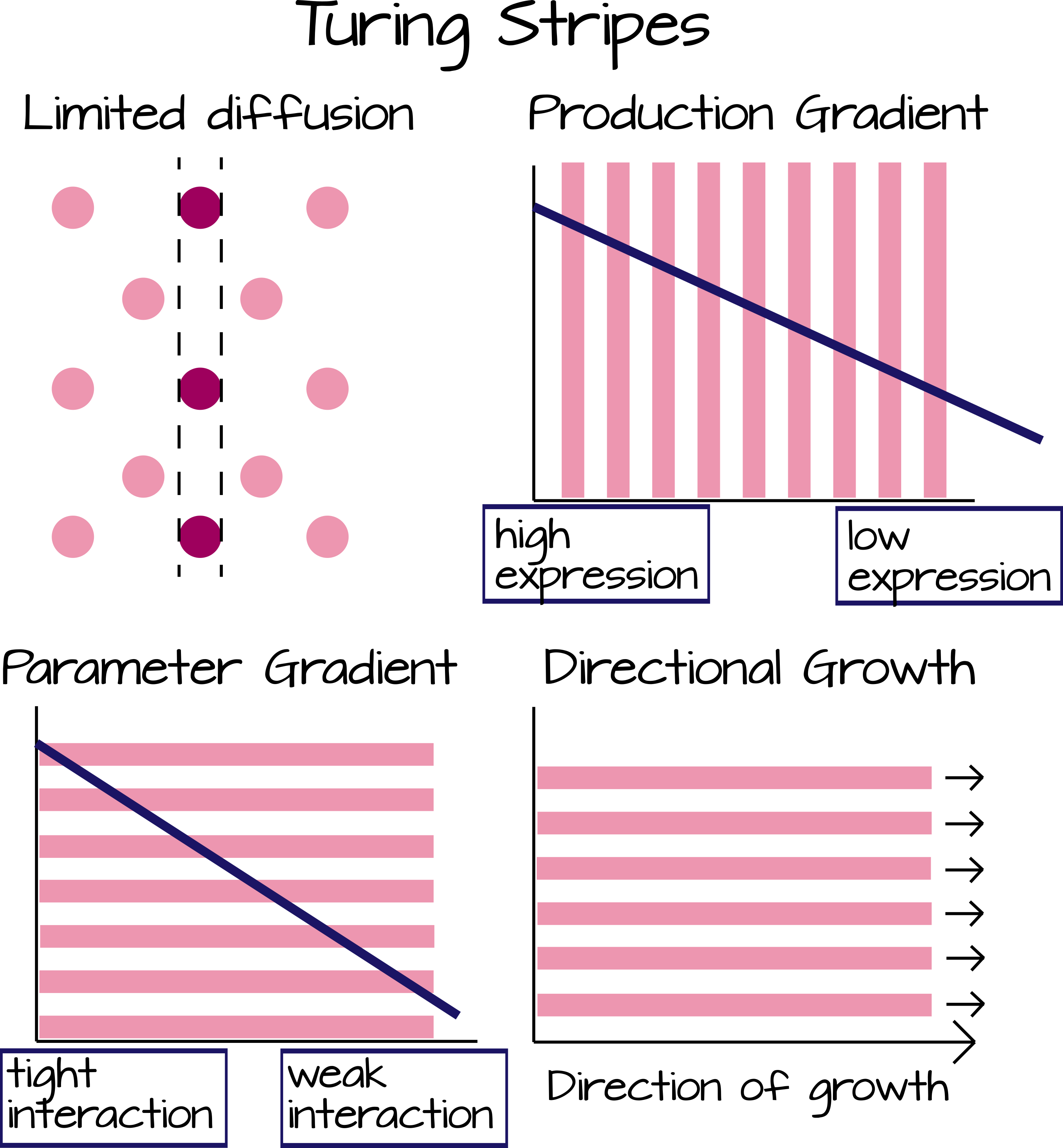
Figura 4.22: Escenarios bajo los que el modelo de reacción-difusión de Turing puede generar franjas. Imagen disponible bajo licencia Creative Commons CC0.
Cada uno de estos mecanismos ilustra cómo ciertos factores físicos y biológicos pueden influir en el tipo de patrón que se forma en los tejidos, y los modelos computacionales permiten explorar estas dinámicas para entender mejor cómo surgen estos patrones en la naturaleza.
Lectura recomendada
Kondo, S., & Miura, T. (2010). Reaction-diffusion model as a framework for understanding biological pattern formation. Science, 329(5999), 1616-1620.
Ejercicio práctico:
Experimentación con el modelo de patrones de Gray-Scott
En este ejercicio exploraremos cómo modelos de reacción-difusión, como el de Gray-Scott, pueden generar patrones similares a los descritos por Alan Turing. Turing fue uno de los primeros en proponer que las interacciones entre moléculas activadoras e inhibidoras pueden generar patrones espaciales regulares en sistemas biológicos, como manchas y franjas. El modelo de Gray-Scott, por su parte, usa parámetros de “alimentación” (feed) y “muerte” (death) para observar cómo afectan al patrón generado en el tiempo.
Vamos a utilizar el siguiente simulador para experimentar con estos patrones: simulador de Gray-Scott. Sigamos los pasos y respondamos a las preguntas a medida que experimentamos.
Patrón uniforme
Configura los valores: Empecemos con una tasa de alimentación (feed rate) de 0.03 y una tasa de muerte (death rate) de 0.062. Haz clic en el lienzo (canvas): Observemos cómo se genera un patrón.
Pregunta: ¿Por qué podríamos describir este patrón como “aburrido” (con pocas variaciones visuales)? ¿En qué se parece este patrón al modelo de Turing?
Respuesta: Este patrón puede parecer “aburrido” porque las tasas son demasiado bajas para permitir que surjan patrones complejos. Esto crea un equilibrio estable y uniforme en el tejido, similar a un estado de reposo en el modelo de Turing, donde las variaciones en los activadores e inhibidores no alcanzan a producir diferencias visibles. Sin embargo, se observa un “aro en expansión”, debido a cómo interactúan los activadores y los inhibidores con estos parámetros específicos de baja tasa. Este fenómeno revela el comportamiento de la difusión en una situación de equilibrio. El activador inicia una onda de activación que se expande hacia el exterior mientras el inhibidor actúa rápidamente para estabilizar y apagar esa activación. Esto crea un frente que se difunde y luego se apaga, en lugar de formar un patrón repetitivo o estable. En el modelo de Turing, este tipo de patrón es comparable a un estado de reposo dinámico donde la activación inicial es insuficiente para generar estructuras persistentes. Aunque vemos un efecto visual interesante, el sistema no alcanza el nivel de autoorganización necesario para crear patrones de puntos o franjas debido a las bajas tasas de retroalimentación y difusión en el activador e inhibidor.
Patrón de puntos
Configura los valores: Seleccionemos el preset “Solitons” y hagamos clic en el lienzo en varios puntos aproximadamente equidistantes. Los solitones son patrones de manchas o “puntos” autoorganizados que se distribuyen regularmente en el espacio. Estos patrones suelen ser formaciones aisladas y estables, que mantienen su forma mientras se mueven o interactúan con otros solitones.
Pregunta: ¿Qué observamos en el patrón de puntos? ¿Cómo se relaciona esto con el modelo de Turing en términos de la distribución de activadores e inhibidores?
Respuesta: Al usar “Solitons,” vemos una distribución regular de puntos o manchas. Esto se relaciona con el modelo de Turing porque los puntos representan áreas donde el activador se ha acumulado, y el inhibidor alrededor evita que se formen más activadores cerca. Esto es posible cuando el inhibidor se difunde más rápido que el activador, permitiendo que los puntos se organicen en patrones espaciados.
Cambios en la tasa de alimentación y muerte
Ajuste de valores: Seleccionemos el preset “Solitons”, cambiemos la tasa de alimentación a 0.56 y la tasa de muerte a 0.062 y hagamos clic en el lienzo en varios puntos aproximadamente equidistantes.
Pregunta: ¿Cómo cambia el patrón de puntos al incrementar la tasa de alimentación y muerte? ¿Qué implicaciones biológicas podría tener un cambio en estas tasas en un sistema natural?
Respuesta: Con tasas de alimentación y muerte más altas, el patrón se vuelve más caótico y dinámico. Las manchas pueden comenzar a expandirse o conectarse, formando patrones más complejos o inestables. En un sistema biológico, cambios en estas tasas podrían representar cambios en la producción o degradación de moléculas en un organismo, lo cual puede llevar a patrones menos definidos o alterados en la estructura.
Generación de franjas
Configura los valores: Seleccionemos el preset “Solitons”, cambiemos la tasa de alimentación a 0.053 y la tasa de muerte a 0.065 y hagamos clic en el lienzo en varios puntos aproximadamente equidistantes.
Pregunta: ¿Qué diferencias en la configuración de estos parámetros nos permitieron obtener franjas en lugar de puntos? ¿Qué podrían representar estos cambios en un sistema biológico (e.g., franjas en la piel de algunos animales)?
Respuesta: Para generar franjas, la tasa de difusión del inhibidor debe ser significativamente mayor que la del activador. Este cambio de parámetros permite que el patrón se alargue en franjas en lugar de puntos aislados. En sistemas biológicos, este tipo de patrón puede relacionarse con franjas en la piel de algunos animales, donde las células responden a gradientes de moléculas activadoras e inhibidoras para formar estas marcas.
Interacción en el patrón durante la generación
Haz clic en el lienzo mientras se genera un patrón.
Pregunta: ¿Qué sucede cuando interactuamos con el lienzo durante la generación del patrón? ¿Cómo podríamos interpretar esto en términos de un cambio ambiental o una perturbación en un organismo en desarrollo?
Respuesta: Al hacer clic en el lienzo durante la generación, se introduce una nueva fuente de activador e inhibidor, lo cual altera el patrón existente. En un contexto biológico, esto podría representar una perturbación o cambio en el ambiente de desarrollo del organismo, como una lesión o un cambio en el suministro de nutrientes, que altera el desarrollo normal de patrones en el tejido.
Factores bioquímicos que afectan las tasas de alimentación y muerte
Pregunta: ¿Qué tipo de propiedades moleculares o bioquímicas podrían influir en las tasas de alimentación y muerte en sistemas biológicos reales? ¿Qué factores podrían hacer que ciertas moléculas se difundan o se degraden más rápidamente?
Respuesta: La tasa de alimentación y muerte en sistemas biológicos reales puede verse afectada por factores como la velocidad de síntesis de proteínas, la eficiencia de las enzimas que degradan moléculas, la afinidad de los receptores celulares y la capacidad de transporte de moléculas a través de membranas. La difusión rápida y una mayor estabilidad pueden ser cruciales para establecer patrones claros y regulares en el tejido.
Exploración libre
Pregunta: Experimentemos con variaciones pequeñas en los valores de alimentación y muerte. ¿Qué otros patrones observamos y cómo podrían relacionarse con patrones en organismos reales?
4.2.2.9.5 Inherencia y la Síntesis moderna
El concepto de inherencia se vincula a una tradición de pensamiento evolutivo paralela a la de Darwin y Wallace. Sus raíces se remontan a la idea de “organización con propósito” de Immanuel Kant y a teorías como la Naturphilosophie de Goethe, las “leyes de forma” de Étienne Geoffroy Saint-Hilaire, y los conceptos físicos de crecimiento y forma de D’Arcy Thompson. También incluye la teoría de la morfogénesis de Turing, que explicó patrones biológicos como resultado de rupturas de simetría dinámica. En este marco, la evolución no depende exclusivamente de la adaptación, sino que se interpreta como una serie de capacidades materiales inherentes, donde la selección natural actúa como un ajuste fino en lugar de ser el motor principal.
A diferencia de otras ideas recientemente reintroducidas al discurso evolutivo (como la plasticidad y la herencia no genética), la inherencia no puede integrarse plenamente en la teoría tradicional de la evolución, ya que sugiere que ciertos patrones y estructuras son predecibles y forman parte de las propiedades físicas y materiales de los organismos multicelulares. En lugar de ser el resultado de ciclos oportunistas de adaptación, estos patrones inherentes ofrecen formas que la selección natural solo ajusta de forma limitada.
Lectura recomendada
Newman, S. A. (2019). Inherency and homomorphy in the evolution of development. Current Opinion in Genetics & Development, 57, 1-8.
Newman, S. A. (2021). Inherency. Evolutionary Developmental Biology: A Reference Guide, 121-132.
Newman, S. A., & Bhat, R. (2008). Dynamical patterning modules: physico-genetic determinants of morphological development and evolution. Physical biology, 5(1), 015008.
Newman, S. A., & Bhat, R. (2009). Dynamical patterning modules: a “pattern language” for development and evolution of multicellular form. International Journal of Developmental Biology, 53(5), 693-705.
4.2.2.10 Canalización
La enorme variación fenotípica que exhiben los organismos actuales y extintos ha sido un tema central para los biólogos del desarrollo y la evolución. Sin embargo, no fue hasta la aparición de la biología del desarrollo evolutivo (evo-devo) en las décadas de 1980 y 1990 cuando la producción de rasgos fenotípicos por los sistemas de desarrollo comenzó a integrarse en las explicaciones evolutivas. En este contexto, tan importantes como la variación son las propiedades del mapa genotipo-fenotipo que afectan la capacidad de producir y mantener dicha variación. Entre estas propiedades destacan la modularidad, integración, canalización y plasticidad, ya que se considera que desempeñan un papel central en estructurar y modular la cantidad de variación fenotípica disponible para la selección, influyendo así en el potencial de cambio evolutivo de los rasgos fenotípicos. En particular, la canalización se refiere a la robustez de los rasgos fenotípicos frente a cambios genéticos y ambientales, siendo reconocida como una propiedad que afecta la propensión de los rasgos a variar.
El término canalización fue acuñado por Waddington para describir la capacidad de los sistemas de desarrollo de mantener los rasgos fenotípicos invariantes ante disturbios genéticos y ambientales. Las ideas de Waddington sobre la canalización están estrechamente relacionadas con su visión del papel de los procesos de desarrollo en el mapa genotipo-fenotipo (G-P), representado mediante la metáfora del paisaje epigenético (Fig. 4.23). En este paisaje, se visualiza una superficie con valles que representan las distintas trayectorias favorecidas por el desarrollo y una bola que, en el esquema original, simboliza una célula individual.
Figura 4.23: Representación del ‘paisaje epigenético’ de Waddington. (A) La canica representa un sistema biológico (por ejemplo, una célula) al borde de tomar un camino de desarrollo hacia uno de varios estados alternativos más diferenciados, representados por las tres depresiones finales en la base de la pendiente. (B) Una visión desde detrás de un paisaje epigenético. La forma de la pendiente está determinada por la tensión de varias cuerdas interconectadas (productos génicos interactuantes) que están sujetas a estacas clavadas en el suelo (genes). Imagen tomada de Fusco et al. (2014).
Esta metáfora se ha ampliado posteriormente para incluir el desarrollo de tejidos, órganos e individuos. La superficie del paisaje epigenético se moldea por las interacciones entre genes y sus productos a lo largo de la ontogenia, determinando la profundidad de los valles (Fig. 4.24). Los valles más profundos indican trayectorias más amortiguadas frente a perturbaciones externas, lo que da lugar a rasgos más canalizados. Nótese que el efecto ambiental puede producir el mismo o distinto efecto que los genes sobre el fenotipo, siendo esta la base la existencia de fenocopias (variaciones fenotípicas inducidas por factores ambientales que imitan las características de un genotipo específico, pero no son hereditarias). Por otro lado, los atavismos (del latín atavus, que significa el cuarto abuelo en línea ascendente) son la reaparición de caracteres que no estaban presentes en los ancestros inmediatos, pero que sí existieron en antecesores remotos. Desde la perspectiva del “paisaje epigenético” de Waddington, los atavismos pueden interpretarse como la reapertura de canales de desarrollo que habían sido cerrados, permitiendo que rutas fenotípicas ancestrales vuelvan a expresarse bajo ciertas condiciones. Estos caracteres, que parecían haber desaparecido a lo largo de la evolución, pueden emerger espontáneamente o ser inducidos experimentalmente, lo que se conoce como atavismos inducidos. Por ejemplo, mediante la manipulación genética o epigenética, es posible activar genes silenciados que controlaban rasgos ancestrales, como la aparición de dientes en aves modernas o la formación de extremidades adicionales en vertebrados. Los atavismos inducidos ofrecen una ventana única para explorar cómo los mecanismos del desarrollo y la evolución interactúan para conservar, modificar o reactivar características a lo largo del tiempo evolutivo.
Figura 4.24: Representación del ‘paisaje epigenético’ de Waddington ilustrando diferentes escenarios del dominio genético. Las cuerdas moradas y verdes representan los productos de dos alelos distintos del mismo gen (representados por las estacas): (A) Homocigosis, donde ambas cuerdas tienen la misma longitud y tensión. (B) Heterocigosis con dominancia completa, donde las cuerdas son asimétricas: tienen distinta longitud y una de ellas no ejerce tensión (está floja). (C) Heterocigosis con dominancia parcial, donde las cuerdas son asimétricas con diferencias en longitud, dirección y tensión. (D) Heterocigosis con codominancia, donde las cuerdas se disponen de manera simétrica, con la misma longitud pero en direcciones opuestas. (E-F) Genes modificadores, que influyen en la acción del gen principal (G). (H-J) Determinación poligénica, donde varios genes interactúan para determinar un fenotipo o carácter. (K) Pleiotropía, donde un gen afecta múltiples rasgos o efectos fenotípicos. Imagen modificada de Fusco et al. (2014).
Animación que ilustra la idea original del “paisaje epigenético”. Waddington veía las células como guijarros rodando por una montaña con colinas y valles. El fondo de los valles representa los estados de diferenciación o los estados celulares. Video tomado de amalabgenetics.
Waddington propuso que la forma del paisaje epigenético estaba modelada por la selección natural. A partir de la observación de que los especímenes de tipo silvestre tienden a ser menos variables fenotípicamente que los mutantes, sugirió que la selección estabilizaba el desarrollo para producir rasgos canalizados. La ventaja selectiva atribuida a la canalización radica en garantizar la producción del fenotipo óptimo bajo condiciones variables. De forma similar, Schmalhausen planteó que los mecanismos autorregulatorios evolucionaron como respuestas adaptativas a cambios ambientales y genéticos. El concepto de canalización ha generado un intenso debate desde que fue formulado, y no existe una perspectiva única y unificada sobre muchos de los aspectos que lo definen.
4.2.2.10.1 Canalización: un concepto escurridizo en la biología evolutiva del desarrollo
El concepto de canalización ha sido definido de múltiples maneras, lo que ha generado confusión, especialmente porque términos como robustez fenotípica, homeostasis, amortiguamiento y estabilidad del desarrollo se emplean frecuentemente como sinónimos, aunque no siempre refieren al mismo fenómeno.
A finales del siglo XX se destacó la ausencia de una definición formal que integre la canalización dentro de un marco de genética de poblaciones, necesario para estudiar cómo y por qué la robustez fenotípica se originó en la evolución. En este contexto, la canalización se definió considerando la varianza genética de los rasgos cuantitativos, que depende del número de genes, la distribución de las frecuencias alélicas y la magnitud de los efectos de esos genes en el fenotipo. Así, la canalización se refiere a la reducción de la variabilidad, entendida como la tendencia a variar, más que al nivel real de variación presente en una población.
Desde esta perspectiva, el estudio de la canalización es el análisis de la evolución de los mecanismos que regulan la evolucionabilidad de los rasgos fenotípicos. Los rasgos más canalizados mostrarán una menor propensión a variar bajo el efecto de nuevas mutaciones y perturbaciones ambientales en comparación con los menos canalizados. Este enfoque se centra en la variación fenotípica introducida por el aporte de nuevas mutaciones en cada generación, es decir, la varianza mutacional.
Dado que la capacidad de generar variación heredable determina el potencial de respuesta a la selección, se espera que los rasgos con mayor varianza mutacional sean más evolutivos que los rasgos canalizados. Sin embargo, como discutiremos más adelante, la canalización también puede aumentar la evolutividad si limita la expresión de nuevas mutaciones, en lugar de su ocurrencia.
4.2.2.10.1.1 Robustez fenotípica frente a factores genéticos y ambientales
La canalización se define generalmente en función del tipo de perturbación contra la cual el fenotipo está amortiguado. La canalización genética se refiere a la reducción del efecto de perturbaciones heredables en los rasgos fenotípicos, mientras que la canalización ambiental limita los efectos de cualquier tipo de perturbación no heredable.
La canalización genética está principalmente relacionada con la robustez fenotípica frente a nuevas mutaciones, aunque en un sentido más amplio también incluye la resistencia frente a perturbaciones epigenéticas. Esto implica que los nuevos alelos con potencial efecto en los rasgos fenotípicos no se expresan en ciertos contextos genéticos debido a la acción de mecanismos amortiguadores. Dado que la expresión de un alelo está influenciada por la presencia de otros alelos, la canalización genética es un fenómeno epistático.
La robustez fenotípica frente a factores ambientales se distingue entre variación macroambiental y microambiental. La variación macroambiental incluye factores externos que afectan a muchos individuos, como la temperatura o los nutrientes mientras que la variación microambiental se refiere a procesos estocásticos o indeterminados internos, como fluctuaciones aleatorias en la concentración o difusión de moléculas. En un sentido amplio, la canalización ambiental incluye la amortiguación frente a ambos tipos de efectos. Sin embargo, algunos reservan el término estabilidad del desarrollo para referirse específicamente a la robustez frente a factores microambientales internos. La canalización frente a factores macroambientales resulta en la producción de rasgos fenotípicos similares en diferentes entornos. No obstante, aún se debate si los mismos mecanismos explican ambos tipos de canalización. La evidencia disponible sugiere tanto una falta de concordancia como asociaciones significativas entre las medidas que describen la robustez fenotípica frente a perturbaciones macro- y microambientales, lo que indica que pueden ser etiológicamente distintas.
Tan importante como la robustez fenotípica frente a la variación ambiental es la capacidad de los genotipos de originar diferentes fenotipos en distintos entornos, un fenómeno conocido como plasticidad fenotípica (ver capítulo “Plasticidad del Desarrollo y Evolución”). Desde su formulación original por Waddington, estas propiedades se consideran relacionadas porque reflejan diferentes interacciones genotipo-ambiente. Los rasgos más canalizados suelen mostrar normas de reacción planas (relación entre genotipos y entornos). Los rasgos plásticos, en cambio, exhiben valores distintos según los factores externos a los que estén expuestos. Esta aparente paradoja surge, en parte, del nivel de análisis: un sistema puede ser robusto en su conjunto mientras que sus componentes muestran plasticidad. Por ejemplo, la plasticidad del desarrollo puede permitir alcanzar fenotipos similares mediante trayectorias de desarrollo distintas. Por ello, el término “fenotipos dinámicamente estables” sería más adecuado para describir la relación entre la variación en los procesos subyacentes y la insensibilidad observada a perturbaciones macroambientales.
La canalización frente a la variación microambiental se refiere a la estabilidad de los sistemas de desarrollo frente a perturbaciones internas, conocidas como ruido del desarrollo, que contribuyen a la inestabilidad dentro de un entorno y constitución genética determinados. Estas perturbaciones, de naturaleza estocástica a nivel molecular, incluyen, entre otras, el movimiento browniano de moléculas y las fluctuaciones en la concentración de productos génicos relevantes a lo largo de gradientes morfogenéticos. En otras palabras, la canalización frente a la variación microambiental se define como la fidelidad con la que un genotipo produce caracteres fenotípicos dentro de un individuo, a pesar de las fluctuaciones aleatorias en su entorno interno.
4.2.2.10.2 Mecanismos de canalización genética y ambiental
Las explicaciones sobre cómo se logra la robustez fenotípica abarcan desde mecanismos a nivel molecular hasta aquellos que consideran la canalización como una propiedad emergente de la arquitectura genético-desarrollativa.
4.2.2.10.2.1 Mecanismos a nivel molecular
Los mecanismos moleculares actúan a lo largo de todo el proceso que lleva desde la transcripción de genes hasta la traducción y ensamblaje de proteínas. Una estrategia sencilla pero efectiva para amortiguar perturbaciones consiste en aumentar la cantidad de producto generado en cada etapa. Por ejemplo, un incremento en la activación de promotores o en la producción de ARNm puede reducir la variación. Sin embargo, este enfoque es costoso, lo que ha favorecido la evolución de estrategias más eficientes como el ajuste fino.
En este sentido, las chaperonas moleculares – proteínas que asisten en el plegamiento y ensamblaje de otras proteínas – han recibido mucha atención. Una proporción significativa de proteínas es propensa a un plegamiento incorrecto debido a interacciones desviadas. Las chaperonas desempeñan un papel clave manteniendo las proteínas en sus estados nativos y asistiendo en nuevos eventos de plegamiento. Además, cuando ocurre un plegamiento erróneo o una agregación incorrecta, las chaperonas facilitan el desenrollamiento, desagregación y eventual degradación proteolítica. Por este motivo, se han postulado como mecanismos que amortiguan la variación fenotípica.
Una chaperona bien estudiada es Hsp90, que interviene en procesos de transducción de señales. Se ha demostrado que alteraciones en su función aumentan la variación morfológica. Hsp90 estabiliza proteínas clientes, y su disfunción genera inestabilidad en estas, lo que produce fenotipos alterados y ruptura de la canalización. Bajo condiciones normales, Hsp90 acumula variación silenciosa que se manifiesta únicamente en contextos evolutivos específicos. Además, se ha descubierto que Hsp90 también participa en la supresión de mutaciones de novo, como en el control de la expansión de transposones mediante la biogénesis de ARN piwi-interactuante (piRNA) en Drosophila. Más recientemente, se ha demostrado que el efecto de Hsp90 depende de las presiones selectivas. En poblaciones con baja presión selectiva, Hsp90 aumenta la influencia de mutaciones espontáneas, mientras que en poblaciones naturales el efecto es opuesto.
4.2.2.10.2.2 Canalización como propiedad emergente
En lugar de ser atribuida a genes puntuales, la robustez fenotípica puede emerger de la arquitectura genético-desarrollativa. Propiedades como la redundancia entre vías, las interacciones epistáticas o el efecto promedio de múltiples fuentes independientes de variación contribuyen a la canalización.
Por ejemplo, la relación entre genotipos y fenotipos suele ser no lineal, lo que significa que la cantidad de variación fenotípica generada en un contexto de desarrollo depende de las relaciones complejas en el mapa genotipo-fenotipo (G-P). Un caso ilustrativo es el factor de señalización Fgf8, implicado en el desarrollo craneofacial. Se ha observado que una reducción progresiva en la dosis de Fgf8 no produce cambios graduales en la variación craneofacial. En cambio, la morfología se mantiene inalterada hasta alcanzar un umbral crítico, por debajo del cual los cambios son significativos y la varianza morfológica es mayor. Este ejemplo apoya la idea de que mecanismos generales derivados de la arquitectura no lineal del desarrollo pueden explicar los patrones de robustez fenotípica. También destaca cómo la variación críptica puede surgir como producto de estas no linealidades.
4.2.2.10.3 ¿Cómo miden los biólogos la canalización?
A pesar de ser un concepto esquivo, se han realizado numerosos intentos para obtener medidas precisas de la canalización. En general:
- La canalización frente a factores macroambientales se evalúa como la precisión con la que se producen rasgos fenotípicos consistentes en diferentes individuos de una población.
- La canalización frente a factores microambientales se mide como la exactitud con la que un genotipo dado produce caracteres simétricos dentro de un individuo (evaluada mediante la asimetría fluctuante, o FA) o fenotipos consistentes entre individuos que comparten el mismo ambiente externo.
El principio central es que la canalización se manifiesta fenotípicamente como una variación limitada, mientras que los rasgos menos canalizados se caracterizan por una mayor variación entre individuos o entre partes repetidas dentro de un mismo individuo.
4.2.2.10.3.1 Variación entre individuos
La cantidad de variación en un rasgo específico entre individuos se considera un indicador del grado de canalización, bajo el supuesto de que esta medida refleja el nivel de amortiguación del rasgo frente a perturbaciones genéticas y ambientales.
Los experimentos seminales de Waddington se basaron en esta idea. En un estudio clásico con Drosophila en 1957, Waddington expuso larvas en desarrollo a estrés térmico extremo, observando un aumento en la dispersión fenotípica entre individuos para un rasgo vascular en las alas. Esto lo llevó a concluir que en condiciones normales los fenotipos de las venas estaban altamente canalizados, y que solo bajo estrés severo se desviaban de esta canalización. Este tipo de variación puede medirse mediante parámetros estadísticos simples, como la varianza o la desviación estándar, o mediante análisis más complejos que comparan la similitud de varianzas entre grupos sometidos a diferentes condiciones ambientales.
4.2.2.10.3.2 Asimetría fluctuante
Los componentes de la asimetría pueden dividirse en asimetría direccional (DA), definida como la variación entre lados derecho e izquierdo en toda una muestra, y la asimetría fluctuante (FA), definida como las diferencias entre ambos lados para cada individuo. La FA representa el componente aleatorio y no direccional de la asimetría, ya que el ruido del desarrollo no afecta preferentemente a un lado. Para calcularla, se necesitan medidas de ambos lados de la estructura estudiada. Los test sobre FA se basan en la idea de que, durante el desarrollo, las partes correspondientes de un individuo (por ejemplo, los lados izquierdo y derecho de una estructura bilateral) deberían emerger como copias especulares. Las desviaciones aleatorias de este patrón se interpretan como imprecisiones en los procesos de desarrollo.
Para analizar los componentes de la DA y la FA, se utiliza una adaptación del Análisis de Varianza (ANOVA) con el individuo y el lado como factores. Como la FA suele tener valores muy bajos, se suelen realizar mediciones repetidas de las mismas variables para garantizar que el error de medición sea menor que la magnitud de la FA. Estos enfoques ofrecen herramientas valiosas para evaluar la robustez fenotípica mediante la variación morfológica, proporcionando evidencias de los procesos subyacentes que regulan la canalización.
4.2.2.10.4 Evolución de la canalización: ¿Adaptativa, congruente o intrínseca?
Existen tres hipótesis principales sobre las causas evolutivas de la canalización genética: adaptativa, congruente e intrínseca.
4.2.2.10.4.1 Hipótesis adaptativa
La hipótesis adaptativa (Fig. 4.25A) sugiere que la canalización genética evolucionó como producto de la selección contra los efectos perjudiciales de las mutaciones y la recombinación. Según esta visión, la selección natural favorecería mecanismos que amortigüen la variación genética porque esto incrementa la robustez fenotípica y, en consecuencia, la adecuación biológica individual (fitness).
Otra variante de esta hipótesis plantea que la canalización genética es un subproducto de la canalización ambiental, ya que la selección se dirige principalmente a la robustez frente a perturbaciones ambientales. En ambos casos, se relaciona una mayor canalización con un aumento en la adecuación biológica.
Waddington acuñó el término selección canalizadora para describir el proceso por el cual la selección estabiliza el promedio poblacional de un rasgo al favorecer mecanismos que suprimen la expresión fenotípica de la variación genética. Sin embargo, esta estabilización también podría lograrse mediante la eliminación o fijación de alelos, aunque este proceso no preserva la variación genética, a diferencia de la selección canalizadora. Esto tiene implicaciones a largo plazo, ya que solo la selección canalizadora mantiene el potencial para el cambio fenotípico.
No obstante, esta hipótesis ha generado debate porque la canalización frente a mutaciones no puede superar un límite: la selección estabilizadora elimina la variación necesaria para que la canalización genética continúe evolucionando.
4.2.2.10.4.2 Hipótesis congruente
La hipótesis congruente sugiere que la canalización genética surge de la selección de alelos canalizadores que reducen la influencia de las perturbaciones ambientales sobre la variación fenotípica. Si el fenotipo óptimo se mantiene constante en diferentes entornos, los alelos que reducen la variación fenotípica en un ambiente variable serán favorecidos. Por el contrario, si el fenotipo óptimo cambia, se espera que la selección favorezca la plasticidad fenotípica. Esta hipótesis implica que los mismos mecanismos subyacen tanto a la canalización ambiental como a la genética, lo que vincula ambas formas de robustez.
4.2.2.10.4.3 Hipótesis Intrínseca
La hipótesis intrínseca (Fig. 4.25B) plantea que la canalización genética no es el resultado de la selección, sino una propiedad emergente de procesos genético-desarrollativos complejos. Según esta visión, la robustez frente a mutaciones es un prerrequisito para la vida compleja, ya que los organismos no tolerarían los niveles observados de alelos con efectos deletéreos sin dicha robustez.
Esta perspectiva está vinculada a la no linealidad del mapa genotipo-fenotipo (G-P). Debido a las relaciones no lineales, grandes perturbaciones en los procesos de desarrollo pueden no tener efecto en la variación fenotípica si ocurren dentro de un rango específico de valores en el paisaje fenotípico.
Las curvaturas en este paisaje reflejan los efectos de las interacciones genéticas y epigenéticas sobre los rasgos fenotípicos. Por ejemplo, redundancias en las redes de regulación genética hacen que los sistemas sean más estables frente a mutaciones.
Simulaciones de redes de regulación genética han demostrado que la robustez frente a mutaciones puede surgir incluso en ausencia de selección estabilizadora. Además, estudios recientes, como los realizados con el factor de señalización Fgf8, muestran cómo propiedades intrínsecas del mapa G-P modulan la cantidad de varianza fenotípica.
En resumen, mientras que las hipótesis adaptativa y congruente se centran en la selección como fuerza impulsora, la hipótesis intrínseca resalta cómo las propiedades no lineales y emergentes del desarrollo contribuyen a la canalización genética sin necesidad de intervención directa de la selección natural.
Figura 4.25: (A) La canalización genética evoluciona bajo la influencia de la selección estabilizadora en torno al fenotipo óptimo. (B) La canalización genética es una propiedad intrínseca que resulta de la no linealidad del mapa Genotipo-Fenotipo. Imagen tomada de Gonzalez & Barbeito-Andrés (2021).
4.2.2.10.5 Canalización y evolucionabilidad de los rasgos fenotípicos
La canalización es un concepto fundamental en evo-devo porque modula la producción y expresión de la variación fenotípica que está sujeta a la selección natural.
Por un lado, los rasgos más canalizados tienden a tener un menor potencial de cambio frente a perturbaciones genéticas y ambientales. En contraste, los genotipos con alta variabilidad (es decir, con menor estado de canalización) pueden cambiar su fenotipo más fácilmente que los genotipos altamente canalizados cuando enfrentan el mismo tipo de cambio mutacional o ambiental.
A nivel poblacional, cualquier proceso que reduzca la variación expresada de un rasgo disminuye su capacidad evolutiva o evolucionabilidad. Esto implica que los rasgos altamente canalizados tienen menor probabilidad de evolucionar bajo las mismas presiones selectivas. Por otro lado, se ha argumentado que la robustez frente a mutaciones y cambios ambientales puede, en realidad, aumentar la evolucionabilidad. Esto se basa en la idea de que la canalización frente a la variación genética permite la acumulación de mutaciones y alelos que no se expresan fenotípicamente, pero se mantienen en las poblaciones como variación genética críptica. Bajo condiciones normales, el espacio fenotípico ocupado es más pequeño que el espacio genotípico (Fig. 4.26A). Sin embargo, cambios drásticos en el entorno o perturbaciones pueden tener un efecto des-canalizador, revelando esta variación genética críptica (Fig. 4.26B).
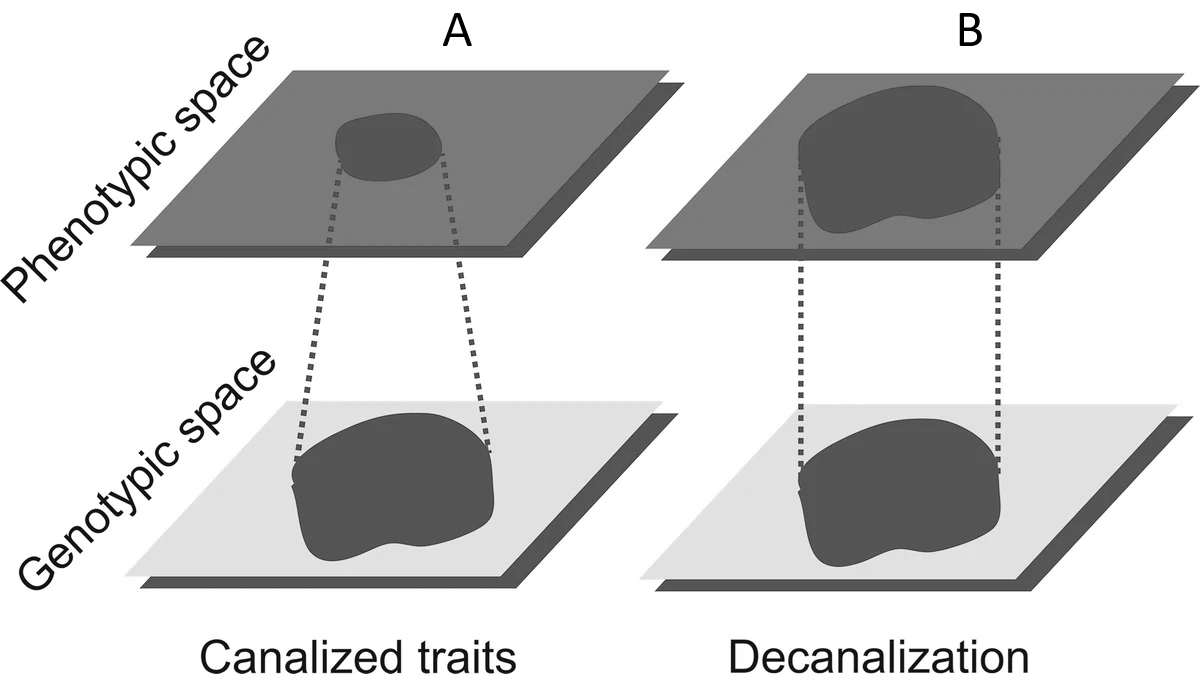
Figura 4.26: (A) (A) Los rasgos canalizados muestran menor variación en el espacio fenotípico que en el espacio genotípico. (B) Tras una perturbación genética o ambiental, la variación genética críptica acumulada se libera, aumentando la varianza en el espacio fenotípico. Imagen tomada de Gonzalez & Barbeito-Andrés (2021).
La des-canalización expone nuevas variaciones fenotípicas heredables, que están sujetas a la selección natural, aumentando así la capacidad de los organismos para responder a nuevas presiones selectivas y, en consecuencia, su potencial de cambio evolutivo. Este fenómeno ha sido interpretado como evidencia de la ventaja selectiva de los mecanismos que incrementan la canalización.
Este aparente paradoja – menor variación fenotípica acompañada de alta variación genética – fue articulada por Schmalhausen, quien propuso que la selección natural favorece mecanismos que permiten a los organismos resistir perturbaciones ambientales mientras mantienen su capacidad de adaptarse a cambios ambientales. El término “capacitancia evolutiva” describe esta habilidad para ocultar y liberar variación genética críptica.
El papel de la variación críptica como soporte de la canalización ha sido cuestionado por algunos autores. En modelos con interacciones genéticas (epistasis) y genotipo-ambiente, los genes sin expresión fenotípica en un contexto genético o ambiental específico pueden expresarse bajo condiciones diferentes, incluso en ausencia de canalización. Este fenómeno, conocido como variación condicionalmente neutra, implica que loci que son neutros en ciertas condiciones pueden volverse adaptativos en un nuevo contexto genético o ambiental. Por tanto, la variación condicionalmente neutra podría explicar la aparición de nuevos fenotipos sin la necesidad de recurrir a mecanismos de canalización.
4.2.2.10.6 Direcciones futuras
El estudio de la canalización ha estado marcado por visiones aparentemente opuestas respecto a los mecanismos que promueven la robustez fenotípica y las causas evolutivas e implicaciones de la canalización. Para avanzar en este campo, será clave integrar estas dicotomías en una agenda más comprensiva.
4.2.2.10.6.1 Integración de mecanismos en distintos niveles
La robustez fenotípica puede lograrse mediante mecanismos específicos que operan en distintos niveles, desde escalas genéticas y celulares hasta redes más amplias que afectan al organismo completo. Estos niveles no son mutuamente excluyentes; más bien, interactúan dinámicamente para estabilizar el fenotipo.
En lugar de considerar estos niveles como fuentes separadas e independientes de explicación, es necesario adoptar una perspectiva que integre sus interacciones. Según Nijhout et al. (2017), una visión más realista emerge cuando el fenotipo canalizado se entiende como el resultado de múltiples factores subyacentes que interactúan dinámicamente para mantener un estado estable.
4.2.2.10.6.2 Causas evolutivas de la canalización
Otro tema que genera debates en la literatura es el origen evolutivo de la canalización:
- ¿Es un producto de la selección para alcanzar estados más adaptados?
- ¿O es una propiedad intrínseca de los sistemas de desarrollo?
Es posible que estas explicaciones opuestas no sean mutuamente excluyentes. Por ejemplo, los caracteres generalmente están interconectados con otros componentes del sistema, lo que significa que pueden estar influenciados por selección indirecta, la cual no necesariamente resulta en una adaptación.El desafío futuro será comprender cómo estos rasgos no adaptativos y seleccionados de manera indirecta interactúan dentro del “orquesta del organismo” para producir un fenotipo canalizado.
###### Hacia un enfoque más amplio
Cada vez es más evidente que las aproximaciones binarias en este campo (adaptación vs. propiedad intrínseca) deben superarse en favor de marcos más amplios y comprensivos. Al integrar perspectivas aparentemente contradictorias, se abrirán nuevas oportunidades para entender mejor cómo los organismos estabilizan sus fenotipos y cómo estos procesos afectan su potencial evolutivo.
4.2.2.11 Evolucionabilidad
La evolucionabilidad es la capacidad de un sistema biológico para generar variación fenotípica que sea tanto heredable como adaptativa. Ha sido durante mucho tiempo objeto de observaciones anecdóticas y estudios teóricos. Sin embargo, en los últimos años, las causas moleculares de la evolucionabilidad han sido un foco creciente de trabajo experimental. La investigación sobre la evolucionabilidad ha alcanzado su cuarta década de desarrollo. Aunque el término fue usado por primera vez en 1932, suele asociarse con un artículo de 1989 de Richard Dawkins, que describía organismos digitales. Hoy, la investigación sobre evolucionabilidad abarca varias disciplinas, incluyendo la genética de poblaciones, genética cuantitativa, biología molecular y biología del desarrollo. Una de las definiciones más fundamentales de evolucionabilidad es la capacidad de un sistema biológico para generar variación fenotípica que sea tanto heredable como adaptativa. Esta definición es clave porque la variación fenotípica heredable es la base de la evolución, y sin la capacidad de producir variaciones adaptativas, la adaptación a través de la selección natural no sería posible.
Inicialmente, la investigación en evolucionabilidad fue principalmente teórica o basada en pocos estudios experimentales, pero esto ha cambiado gracias a los avances en tecnologías de alta capacidad, permitiendo ahora una comprensión más experimental y mecánica de cómo los sistemas vivos generan variación heredable y adaptativa. Este tipo de estudios es relevante en campos como la biología del desarrollo o la biología del cáncer, y ayudan a entender las causas de la evolucionabilidad en contextos como la resistencia a antibióticos en bacterias o la adaptación de poblaciones frente al cambio climático.
Los hallazgos experimentales en evolucionabilidad se agrupan en tres categorías principales:
Mecanismos moleculares que generan heterogeneidad fenotípica: Estos mecanismos permiten que poblaciones genéticamente idénticas generen variación fenotípica sin necesidad de mutaciones en el ADN. Esto puede facilitar la supervivencia en entornos nuevos o cambiantes, dando tiempo a que se refuercen estos fenotipos mediante mutaciones, duplicaciones génicas, recombinación o modificaciones epigenéticas.
Robustez: La robustez es crucial para la evolucionabilidad, ya que permite que una población evolutiva explore nuevos genotipos sin afectar fenotipos esenciales. Esto genera diversidad genotípica que puede dar lugar a nuevos fenotipos adaptativos o a variación fenotípica cuando el entorno cambia.
Características topográficas del paisaje adaptativo: La forma de este paisaje, como su suavidad y la posición de una población en él, influye en la cantidad de variación fenotípica adaptativa que puede generar una mutación. Estos paisajes adaptativos permiten visualizar las relaciones genotipo-fenotipo y cómo estas afectan la evolucionabilidad.
4.2.2.11.1 Heterogeneidad fenotípica
La variabilidad fenotípica es fundamental para la evolución, ya que proporciona el material sobre el cual actúa la selección natural. Tradicionalmente, se ha considerado que esta variabilidad depende principalmente de mutaciones genéticas y recombinación, pero recientes investigaciones han demostrado que también existen mecanismos no genéticos que pueden generar variaciones fenotípicas significativas en poblaciones genéticamente idénticas (Fig. 4.27). Estos mecanismos —expresión génica estocástica, errores en la síntesis de proteínas, modificaciones epigenéticas y promiscuidad proteica— permiten que surjan fenotipos diversos que pueden ser adaptativos en entornos cambiantes o desfavorables.
Expresión génica estocástica: Este fenómeno, conocido como “ruido génico,” ocurre debido a fluctuaciones aleatorias en la transcripción y traducción, lo que resulta en variaciones de expresión génica incluso en células idénticas genéticamente. Esta variabilidad permite que subpoblaciones desarrollen fenotipos adaptativos, como el estado “persistente” en Escherichia coli, que confiere resistencia temporal a los antibióticos. Aunque este estado es reversible y no implica cambios permanentes en el ADN, otorga a la población tiempo para que surjan mutaciones que establezcan una resistencia duradera.
Errores en la síntesis de proteínas: Las “mutaciones fenotípicas” ocurren durante la síntesis de proteínas debido a errores de transcripción o traducción, que producen proteínas ligeramente distintas sin cambiar el gen que las codifica. Estos errores son mucho más frecuentes que las mutaciones en el ADN y pueden ser adaptativos. En Mycobacterium tuberculosis, por ejemplo, los errores en la síntesis de proteínas generan variantes de la ARN polimerasa que resisten mejor al antibiótico rifampicina, lo cual facilita la adaptación del patógeno en presencia del medicamento.
Modificaciones epigenéticas: Los cambios epigenéticos, como la metilación del ADN y la modificación de histonas, alteran la expresión génica sin modificar la secuencia genética subyacente. Estas modificaciones pueden ser heredables y tener efectos adaptativos. En ciertos cánceres, por ejemplo, la metilación diferencial de genes reguladores permite que algunas células retengan una mayor capacidad proliferativa, impulsando el crecimiento tumoral. Estas adaptaciones epigenéticas permiten que las células respondan rápidamente a cambios en el entorno, facilitando la supervivencia y expansión del cáncer.
Promiscuidad proteica: Algunas proteínas tienen funciones secundarias “promiscuas” que, aunque no esenciales en condiciones normales, pueden convertirse en adaptativas en nuevos contextos ambientales. Esto permite a los organismos utilizar funciones latentes cuando el entorno cambia, facilitando la evolución de nuevas adaptaciones. En la levadura Saccharomyces cerevisiae, la duplicación de genes permitió que una proteína reguladora se especializara en la regulación de diferentes rutas metabólicas, optimizando su funcionalidad en diversos entornos.
Figura 4.27: La heterogeneidad fenotípica es una causa de la evolucionabilidad. (A) La heterogeneidad fenotípica puede crear una pequeña subpoblación de células con un nuevo fenotipo, como el fenotipo de ‘persistencia’ (células rojas en el entorno 1). Este fenotipo puede ser adaptativo, permitiendo a esta subpoblación sobrevivir a desafíos ambientales, como la exposición a antibióticos (entorno 2). Una mutación (cruz roja) puede estabilizar este fenotipo, o generar otro fenotipo adaptativo en el nuevo entorno, como una resistencia en una célula bacteriana ya tolerante. Existen varias fuentes de heterogeneidad fenotípica: (B) La expresión génica aleatoria causa variación en los niveles de transcripción de ARNm entre células. (C) Errores en la síntesis de proteínas, como traducciones incorrectas, generan variaciones en las secuencias de aminoácidos de proteínas a partir del mismo ARNm. (D) Modificaciones epigenéticas producen variación en las secuencias de proteínas, en este caso mediante la lectura incorrecta de codones de parada. Imagen tomada de Payne & Wagner (2019).
Estos mecanismos no sólo generan diversidad fenotípica en ausencia de mutaciones genéticas, sino que también permiten que algunos de estos fenotipos sean “probados” por la selección natural. En algunos casos, las variaciones no genéticas pueden ser estabilizadas por mutaciones genéticas o epigenéticas, lo que asegura su persistencia en generaciones futuras. Este proceso recuerda al fenómeno de la “asimilación genética,” en el cual un rasgo fenotípico inicialmente inducido por el ambiente se convierte en hereditario mediante mutaciones.
En conjunto, estos descubrimientos amplían nuestra comprensión de cómo se genera la variabilidad fenotípica en las poblaciones y cómo esta variabilidad puede influir en la evolución sin depender exclusivamente de mutaciones en el ADN. Además, ponen de relieve la importancia de la heterogeneidad fenotípica en la evolución adaptativa, permitiendo a las poblaciones adaptarse a cambios ambientales y superar barreras sin alterar su código genético fundamental. Esta capacidad de adaptación rápida y flexible subraya la “evolucionabilidad” como una característica clave en la supervivencia y evolución de los organismos.
4.2.2.11.2 Robustez
La robustez frente a mutaciones en el ADN es una propiedad que, en cierto sentido, es opuesta a la heterogeneidad fenotípica no genética. Mientras que la heterogeneidad fenotípica permite que haya variación en los fenotipos sin cambios en el genoma, la robustez asegura que, a pesar de las variaciones genéticas, un fenotipo se mantenga constante.
Muchos rasgos fenotípicos son en cierta medida robustos frente a mutaciones. Ejemplos de esto incluyen la estructura y función de macromoléculas, los patrones de expresión génica en redes regulatorias, y la capacidad de la maquinaria metabólica para sintetizar biomasa. La robustez puede incrementarse mediante diversas estrategias. Por ejemplo, las mutaciones en el ADN que aumentan la estabilidad de proteínas también pueden mejorar la robustez, ya que permiten que la proteína tolere un rango mayor de mutaciones y aún conserve su estructura y función. Además, la duplicación de genes puede aumentar la robustez, ya que genera redundancia, permitiendo que uno de los genes soporte mutaciones sin pérdida funcional. También existen proteínas chaperonas, como Hsp90, que aumentan la robustez en organismos diversos, ayudando a mantener la función de proteínas a pesar de cambios genéticos.
Cuando una mutación no cambia el fenotipo, se genera lo que se llama variación genética críptica. Esta variación no se expresa fenotípicamente, pero puede convertirse en la base para la evolución de nuevas adaptaciones de tres maneras. Primero, cuando cambia el entorno, o si una chaperona pierde funcionalidad, la variación críptica puede revelarse como variación fenotípica. Segundo, esta variación genera diferentes contextos genéticos en los que pueden actuar nuevas mutaciones, lo que permite efectos fenotípicos distintos en cada contexto debido a las interacciones epistáticas. Tercero, esta variación críptica también puede originar nuevas variaciones fenotípicas mediante recombinación.
Un ejemplo interesante de cómo la robustez facilita la evolución es la diversificación del dominio de los dedos de zinc (C2H2) en metazoos. Este dominio permite a los factores de transcripción reconocer y unirse a secuencias de ADN específicas. En metazoos, los aminoácidos no directamente implicados en el contacto con las bases del ADN ayudan a estabilizar la unión a través de enlaces de hidrógeno con la columna fosfato del ADN, lo que permite que el dominio sea robusto frente a mutaciones en los aminoácidos que sí interactúan directamente con las bases. Esto ha facilitado la diversificación de las preferencias de unión al ADN de estos factores de transcripción.
Otro ejemplo de robustez en la evolución es el cambio en las preferencias de unión de los receptores de esteroides. Los receptores ancestrales de estos esteroides se unían a elementos de respuesta a estrógenos; sin embargo, a través de una serie de mutaciones, algunos descendientes de este receptor evolucionaron para unirse a elementos de respuesta a esteroides en lugar de estrógenos. Este cambio fue posible porque la robustez estructural del receptor ancestral permitió una exploración de variantes mutacionales hasta encontrar una configuración de unión diferente sin comprometer su funcionalidad original.
Estos ejemplos ilustran cómo la robustez permite a los organismos explorar nuevas combinaciones genéticas sin afectar sus fenotipos inmediatos, facilitando así la aparición de nuevas adaptaciones. Además, esta propiedad no es exclusiva de proteínas individuales, sino que también se observa en redes de regulación genética, donde múltiples configuraciones pueden dar lugar a fenotipos robustos, pero con potencial para adaptaciones futuras.
4.2.2.11.3 Topografía del paisaje adaptativo
Un paisaje adaptativo es una metáfora utilizada para visualizar cómo la selección natural actúa sobre variaciones genéticas en una población. En este modelo, cada “ubicación” en el espacio representa un genotipo específico, y su “altura” o “elevación” corresponde a su aptitud o eficacia biológica. La evolución adaptativa se entiende como un proceso en el que las poblaciones, a través de mutaciones y recombinación genética, exploran este paisaje y, mediante selección natural, encuentran picos o mesetas de alta aptitud (Fig. 4.28).
Este concepto es central para entender la evolucionabilidad de las especies, ya que la estructura del paisaje y la posición de la población en él determinan cuánta variación beneficiosa pueden generar las mutaciones. En un paisaje suave con un solo pico, las mutaciones probablemente generarán cambios adaptativos, facilitando la evolución. En cambio, un paisaje con múltiples picos locales puede atrapar a la población en un “pico subóptimo”, limitando la evolución adaptativa.
Un aspecto clave que afecta la forma de estos paisajes adaptativos es la epistasis, que se refiere a las interacciones no aditivas entre mutaciones. La epistasis negativa ocurre cuando el efecto combinado de varias mutaciones es menor que la suma de sus efectos individuales, lo que puede reducir la evolucionabilidad al limitar la capacidad de alcanzar nuevos picos adaptativos. Por otro lado, la epistasis positiva facilita el aumento de la aptitud al hacer que el efecto combinado de las mutaciones sea mayor. Un tipo especial de epistasis, la epistasis de signo, crea picos y valles en el paisaje adaptativo, generando regiones de baja aptitud entre los picos, lo que puede impedir que una población alcance picos globales si estos requieren atravesar un valle adaptativo.
Para estudiar estos paisajes adaptativos, se han desarrollado experimentos que permiten “mapear” estos paisajes en organismos completos y en moléculas individuales. Por ejemplo, en la levadura Saccharomyces cerevisiae, se estudió la proteína Hsp90 en condiciones de alta salinidad, revelando un paisaje adaptativo con varios picos locales y un solo pico global de alta aptitud. Este tipo de estudios nos ayuda a comprender cómo la variación genética, junto con la selección natural, permite a las poblaciones explorar y adaptarse a ambientes complejos.
Finalmente, los paisajes adaptativos de baja dimensionalidad pueden ser limitantes, ya que no consideran todas las posibles interacciones mutacionales de un genoma completo. Sin embargo, al incrementar la dimensionalidad (considerando múltiples sitios mutacionales en el genoma), se pueden formar “puentes” o caminos mutacionales que facilitan el acceso a nuevos picos adaptativos. Esto sugiere que, en genomas complejos, los paisajes adaptativos pueden ser menos accidentados, lo que a su vez mejora la evolucionabilidad de las poblaciones al permitir una exploración más amplia de variaciones genéticas.
Figura 4.28: La topografía del paisaje adaptativo influye en la evolucionabilidad. (A) Un paisaje suave con un único pico facilita la evolucionabilidad, ya que las mutaciones pueden generar variaciones fenotípicas adaptativas desde cualquier punto del paisaje, excepto en el pico global. Por ejemplo, los círculos blancos y negros indican dos rutas mutacionales distintas que parten de puntos diferentes y ambas convergen en el pico global mediante pasos mutacionales ascendentes. (B) En contraste, un paisaje con múltiples picos o ‘rugoso’ dificulta la evolucionabilidad, ya que una población en evolución puede quedar atrapada en picos locales subóptimos. Por ejemplo, la ruta mutacional indicada por los círculos blancos lleva al pico global, mientras que la ruta indicada por los círculos negros no lo logra. (C) La forma de un pico adaptativo es consecuencia de la epistasis de magnitud: la epistasis positiva genera picos convexos, mientras que la epistasis negativa genera picos cóncavos. A medida que una población escala un pico adaptativo, la evolucionabilidad tiende a aumentar si el pico es convexo y a disminuir si el pico es cóncavo. (D) La rugosidad del paisaje es resultado de la epistasis de signo, que crea valles adaptativos que pueden ser difíciles de cruzar para una población en evolución (círculos grises correspondientes a la parte B). (E-G) El mismo paisaje adaptativo de la parte A pero representado en gráficos de contorno 2D. Los círculos abiertos indican genotipos y las líneas conectan genotipos que difieren por una sola mutación. Este paisaje puede estudiarse de varias formas: (E) Diseñando genotipos que contengan todas las combinaciones posibles de un pequeño número de mutaciones hasta llegar a un pico. (F) Explorando mediante el escaneo mutacional profundo de un genotipo tipo silvestre, incluyendo todas las mutaciones simples, muchas dobles y algunas triples. (G) Enumerando exhaustivamente todos los genotipos posibles en el caso de paisajes pequeños. Imagen tomada de Payne & Wagner (2019).
4.2.2.11.4 Avances metodológicos
Nuestra capacidad para estudiar las causas moleculares de la evolucionabilidad ha mejorado notablemente gracias a los avances metodológicos recientes. La investigación sobre la heterogeneidad fenotípica ha progresado con dispositivos de microfluidos y microscopía de lapso de tiempo, que permiten analizar la composición, morfología y tasas de crecimiento de células individuales en ambientes dinámicos. Además, técnicas como la hibridación fluorescente in situ y la secuenciación de ARN de célula única (RNA-seq) aportan información sobre la ubicación y abundancia de transcritos de ARN, lo cual ha ayudado a detallar las causas moleculares de la variabilidad fenotípica, como la expresión génica estocástica en bacterias y la variabilidad en células cancerosas.
Para estudiar la robustez mutacional y los paisajes adaptativos, se han desarrollado herramientas como el escaneo mutacional profundo, que permite examinar sistemáticamente los efectos fenotípicos de mutaciones. También, la edición de genes mediante CRISPR-Cas9 facilita la introducción de mutaciones en loci específicos, mientras que tecnologías basadas en chips y métodos de selección in vitro de alta capacidad han permitido ensayar un gran número de genotipos para funciones específicas.
Para comprender cómo estos factores de evolucionabilidad han cambiado en escalas de tiempo evolutivas, se combinan estas metodologías con métodos de máxima verosimilitud, que permiten inferir y reconstruir experimentalmente los genotipos y fenotipos de macromoléculas antiguas, proporcionando una visión evolutiva a largo plazo.
4.2.2.11.5 Evolución de la evolucionabilidad
La evolucionabilidad, o la capacidad de un sistema biológico para generar variación fenotípica hereditable y adaptativa, puede estar sujeta a cambios evolutivos en sí misma. Esto plantea preguntas sobre cómo y por qué evolucionan los mecanismos que favorecen la evolución. Para abordarlo, se exploran tres preguntas clave:
- ¿Pueden evolucionar estos mecanismos? Esto implica investigar si existe variabilidad genética asociada a los mecanismosde evolucionabilidad.
- ¿Realmente evoluciona el mecanismo en entornos naturales o en estudios de laboratorio?
- ¿Es adaptativa la evolución de la evolucionabilidad en sí misma? ¿O es simplemente un subproducto de otros procesos evolutivos no adaptativos, como restricciones de desarrollo, sesgo de mutación o deriva genética?
La heterogeneidad fenotípica es crucial para la evolucionabilidad, ya que proporciona una variedad de fenotipos en ausencia de variación genética, lo que permite que ciertos individuos prosperen en entornos cambiantes. Los mecanismos que producen esta heterogeneidad, como el ruido en la expresión génica o la promiscuidad proteica, tienen bases genéticas, lo que significa que pueden evolucionar. En laboratorio y en la naturaleza, se han observado ejemplos de esta evolución. Por ejemplo, en Saccharomyces cerevisiae, se ha documentado la evolución de niveles elevados de ruido en la expresión de genes de resistencia a antifúngicos, lo que permite a la población sobrevivir en ambientes estresantes. Otros casos incluyen la evolución de la promiscuidad proteica en bacteriófagos, donde los cambios adaptativos en proteínas virales también facilitaron la capacidad de unirse a diferentes receptores celulares.
La robustez frente a las mutaciones permite que una población mantenga su función fenotípica a pesar de variaciones genéticas, y también puede evolucionar. Esto se ha observado en estructuras macromoleculares como el plegamiento de proteínas y en redes de regulación génica. Los estudios muestran que la robustez puede surgir, por ejemplo, de duplicaciones génicas que permiten que una función sea redundante y que una mutación en uno de los genes no cause cambios fenotípicos significativos. Sin embargo, aún no está claro si esta robustez mutacional evoluciona como un rasgo adaptativo que favorece la evolucionabilidad o si es un efecto secundario de otras adaptaciones, como la estabilidad proteica bajo condiciones ambientales adversas.
Los paisajes adaptativos representan la variación de aptitud en función de diferentes genotipos. Cambiar la ubicación de una población en un paisaje adaptativo puede aumentar la evolucionabilidad al permitir el acceso a una mayor variedad de variación fenotípica adaptativa. En un famoso experimento de evolución a largo plazo con Escherichia coli, se observó que una subpoblación de bacterias se posicionó en una región del paisaje que le permitió adaptarse con más éxito al entorno de laboratorio. Aunque esta subpoblación no tenía inicialmente la mayor aptitud, su posición le permitió desarrollar más mutaciones adaptativas, superando eventualmente a las otras subpoblaciones.
Este fenómeno también se ha observado en estudios sobre la evolución de la especificidad de proteínas. En el caso de un receptor hormonal ancestral, por ejemplo, se encontró que la evolución acumuló mutaciones que no afectaban la función de unión específica del receptor pero que ampliaron su capacidad para unirse a otros tipos de secuencias de ADN, aumentando la capacidad evolutiva de la proteína.
Por tanto, las pruebas actuales muestran que la heterogeneidad fenotípica, la robustez y los paisajes adaptativos pueden cambiar evolutivamente, lo que a su vez impacta en la capacidad evolutiva de los organismos. Sin embargo, sigue siendo una pregunta abierta si estos cambios evolucionan específicamente para “mejorar” la evolucionabilidad o si son subproductos de adaptaciones específicas o incluso de procesos no adaptativos.
4.2.2.11.6 Conflictos entre diferentes niveles de selección
Los sistemas biológicos están organizados jerárquicamente: las macromoléculas forman parte de las células, las células se agrupan en organismos completos, y estos en poblaciones. Un cambio genético beneficioso en un nivel de esta jerarquía puede ser perjudicial en otro. Por ejemplo, aunque muchas mutaciones aleatorias en el ADN son perjudiciales para los individuos, algunas mutaciones que aumentan la tasa de mutación del ADN pueden ser ventajosas para una población en su conjunto, especialmente en entornos de estrés, ya que algunos individuos mutantes pueden asegurar la supervivencia de la población o acelerar la adaptación. Estos conflictos son también relevantes para los mecanismos de evolucionabilidad, como aquellos que generan heterogeneidad no genética, ya que esta heterogeneidad podría no beneficiar a todos los individuos en la mayoría de los ambientes.
Existen teorías, como la selección multinivel y la selección de parentesco, que ayudan a predecir cómo puede la evolución resolver estos conflictos. La selección de parentesco, en particular, indica que las adaptaciones a nivel poblacional pueden evolucionar y persistir cuando las poblaciones están formadas por individuos genéticamente similares, ya que sus “intereses” genéticos están alineados con los de la población. Muchos casos de heterogeneidad adaptativa no genética se observan en poblaciones clonales de individuos genéticamente idénticos, donde los intereses individuales están protegidos siempre que sobrevivan algunos de los individuos del clon.
En cuanto a la robustez, la propiedad dual de la heterogeneidad fenotípica, esta suele ser ventajosa a nivel individual. Un ejemplo es cuando una mutación genera una proteína más estable y menos propensa a fallos. En estos casos, la ventaja a nivel individual y la ventaja a nivel poblacional de la evolucionabilidad están alineadas, lo que hace de la robustez una causa de evolucionabilidad cuya explicación evolutiva es más sencilla y libre de conflictos. Sin embargo, esta ausencia de conflicto también dificulta distinguir si la robustez de un rasgo específico surgió como ventaja individual o como una ventaja “de segundo orden” que contribuye a la evolucionabilidad en general, como es el caso de la protección que los chaperones brindan al proteoma.
4.2.2.11.7 Resumen y perspectivas futuras
Impulsada por avances tecnológicos, la investigación sobre las tres principales causas de evolucionabilidad está avanzando rápidamente, y es probable que este progreso continúe. Los mecanismos actualmente estudiados para generar heterogeneidad fenotípica no genética podrían representar solo una pequeña parte de los mecanismos relevantes, y estudios futuros podrían identificar otros, como la edición de ARN o la alosteria proteica. Además, existe un conocimiento limitado sobre cómo los conflictos de selección afectan la evolución de estos mecanismos, especialmente en organismos que no son genéticamente idénticos.
En cuanto a la robustez, si bien se comprenden sus causas en sistemas simples como proteínas o genes duplicados, la comprensión es limitada para sistemas más complejos, tales como los circuitos reguladores de genes y el metabolismo. Las consecuencias evolutivas de la robustez se han documentado en estudios detallados de moléculas como los receptores de hormonas esteroides, aunque tales reconstrucciones son aún escasas.
En el contexto de paisajes adaptativos, apenas comienza a entenderse cómo la topografía del paisaje depende de la epistasis de orden superior y de cómo el ambiente afecta dicha topografía. Además, el conocimiento sobre la topografía del paisaje adaptativo podría facilitar la predicción de trayectorias evolutivas o incluso el redireccionamiento de patógenos hacia regiones de baja evolucionabilidad.
Aunque las tres causas de la evolucionabilidad interactúan, aún no se comprende del todo cómo lo hacen. Por ejemplo, la heterogeneidad fenotípica podría suavizar un paisaje adaptativo si la condición física general de un genotipo equivale al promedio de los fenotipos que produce. Asimismo, una mutación en el ADN que haga robusta a una proteína podría situar al genotipo en una región más suave del paisaje, aunque aún no se ha caracterizado explícitamente el grado de “suavizado” en paisajes adaptativos estudiados experimentalmente.
Además, los mecanismos no genéticos que generan variación fenotípica adaptativa podrían estabilizarse mediante mutaciones en el ADN solo si el genotipo original se encuentra en una región del paisaje donde sus mutantes puedan mantener esa adaptación. También es posible que existan compensaciones entre la robustez y los mecanismos no genéticos de variación fenotípica, lo cual representa un área de investigación que merece mayor atención.
Una última frontera en esta área es entender cómo las causas de la evolucionabilidad pueden evolucionar en sí mismas. Aunque existen evidencias de que todas estas causas pueden cambiar evolutivamente, se sabe menos sobre si esto refleja un valor adaptativo de la evolucionabilidad. Confirmar que la vida puede crear condiciones que favorecen su avance evolutivo proporcionaría una visión poderosa de la capacidad autorreguladora de los sistemas vivos para asegurar su propia adaptabilidad y supervivencia.
Lectura recomendada
Payne, J. L., & Wagner, A. (2019). The causes of evolvability and their evolution. Nature Reviews Genetics, 20(1), 24-38.
Pigliucci, M. (2008). Is evolvability evolvable?. Nature Reviews Genetics, 9(1), 75-82.
4.2.2.11.8 Otros conceptos relacionados con la evolucionabilidad
La plasticidad fenotípica es la capacidad de un organismo para modificar su fenotipo en respuesta a cambios en el ambiente. Esto significa que un mismo genotipo puede producir diferentes fenotipos dependiendo del entorno. La plasticidad puede facilitar la evolución, ya que los cambios adaptativos en el fenotipo inducidos por el ambiente pueden “guiar” la evolución al permitir que las variaciones favorables se estabilicen en el tiempo, incluso a través de modificaciones genéticas (asimilación genética). La plasticidad fenotípica adaptativa permite que la evolución genética encuentre adaptaciones más rápidamente. Eevidencia reciente apoya que la evolución suele avanzar en la dirección que ya ha sido trazada por la plasticidad. A lo largo de períodos de tiempo más extensos, este proceso proporciona un mecanismo biológicamente plausible para que la información ambiental se integre en los organismos, generando sesgos en el desarrollo cuya estructura refleja el entorno selectivo. De esta manera, se facilitan futuras adaptaciones mediante la modificación genética de fenotipos inducidos por el ambiente. Es decir, el desarrollo mantiene el fenotipo inducido por el ambiente hasta que la asimilación genética lo estabiliza en el genoma.
La pleiotropía ocurre cuando un solo gen influye en múltiples rasgos fenotípicos. Este fenómeno fue descrito hace aproximadamente 100 años. Debido a que la pleiotropía parecía ser muy común, surgió la idea de que era un fenómeno “universal”, es decir, que la mayoría de los genes afectarían múltiples rasgos a la vez. Sin embargo, no fue hasta hace poco que se lograron obtener estimaciones cuantitativas de cuán frecuente y extensa es realmente la pleiotropía. Comprender el alcance de la pleiotropía es importante, especialmente al considerar las oportunidades para la evolución, ya que cuanto más pleiotrópicos son los efectos de un gen, mayor es la probabilidad de que el gen afecte de manera desfavorable el fenotipo de algún rasgo. Esto, a su vez, aumenta la posibilidad de que se inhiba el cambio evolutivo. Esta relación está formalizada en el modelo geométrico de Fisher. Fisher desarrolló el modelo geométrico para explicar cómo las mutaciones aleatorias pueden afectar la adaptación de los organismos. Utilizó la metáfora de un microscopio: en este caso, el microscopio tiene varios botones para ajustar su enfoque. Con pocos botones, es más fácil ajustar la imagen, pero a medida que aumenta el número de botones, encontrar el enfoque adecuado al azar se vuelve cada vez más complejo. Fisher compara esto con la evolución, donde cada “botón” representa un rasgo del organismo (como tamaño o forma), y las mutaciones son como ajustes aleatorios. Según el modelo, mientras más complejo es un organismo (es decir, mientras más “botones” o rasgos tiene), menor es la probabilidad de que una mutación aleatoria sea beneficiosa, ya que podría afectar negativamente otros rasgos. Este fenómeno se conoce como el “costo de la complejidad”. Fisher propuso que la evolución avanza más fácilmente mediante pequeños cambios, ya que estos tienen mayor probabilidad de mejorar la adaptación sin provocar efectos negativos en otros rasgos. Trabajos posteriores respaldaron esta idea al observar que en organismos complejos, tanto la probabilidad de fijación de una mutación beneficiosa en una población como el aumento de aptitud derivado disminuyen con la complejidad. Esto sugiere que la adaptación evolutiva es más lenta en organismos complejos debido a la baja probabilidad de que una mutación aleatoria resulte ventajosa en un contexto de múltiples rasgos interdependientes.
Estudios recientes han mostrado que la pleiotropía no es tan amplia ni universal como se pensaba (Fig. 4.29); más bien, parece estar limitada y alineada con un concepto llamado “modularidad variacional” (Fig. 4.30). Esto significa que los efectos de un gen suelen concentrarse en un conjunto específico de rasgos interconectados, en lugar de afectar múltiples características sin relación. Por otro lado estos trabajos también sugieren que las mutaciones pleiotrópicas (que afectan a múltiples rasgos) pueden tener efectos más fuertes en cada rasgo individual de lo que se esperaba. Este efecto de escalado puede hacer que los organismos complejos (con más genes pleiotrópicos) se adapten más rápido, ya que las mutaciones beneficiosas en genes pleiotrópicos tienen más probabilidades de “fijarse” (extenderse en la población) a pesar de afectar a varios rasgos a la vez.
Figura 4.29: Distribución del grado de pleiotropía. En todos los casos, la distribución de los efectos pleiotrópicos es en gran medida en forma de L, con un grado de pleiotropía bajo como mediana. (A) Distribución de pleiotropía que afecta a los rasgos esqueléticos y la forma del cuerpo. En ratones afectan a una pequeña fracción de los rasgos esqueléticos, mientras que en peces óseos tiene un impacto aún más bajo, afectando generalmente a un solo rasgo. (B) La distribución de los efectos pleiotrópicos en levaduras y nematodos muestran que la mayoría de los genes afectan a pocos rasgos en promedio. En levaduras, tanto los rasgos de crecimiento en diferentes entornos como los rasgos fisiológicos tienen una baja pleiotropía. En nematodos y ratones, los genes también afectan a un número limitado de rasgos de desarrollo y morfología. Imagen tomada de Wagner & Zhang (2011).
Figura 4.30: Conceptualización de la pleiotropía modular. La modularidad variacional se produce cuando ciertos grupos de rasgos tienden a variar conjuntamente entre individuos de la misma especie o entre diferentes especies. Este fenómeno ocurre cuando un conjunto específico de genes co-determina un grupo particular de rasgos, un proceso denominado pleiotropía modular, que da lugar a estos módulos variacionales. Imagen tomada de Payne & Wagner (2019).
La modularidad en biología evolutiva se refiere a la organización de los organismos en “módulos,” donde los componentes están más conectados dentro del mismo módulo que entre módulos distintos. Esta estructura permite que los cambios afecten a un grupo de rasgos relacionados sin influir en otros módulos. Así, un cambio en un módulo puede mejorar un conjunto de rasgos coordinadamente sin perjudicar otros aspectos del organismo. La modularidad es clave para la evolución, ya que facilita la adaptación, permitiendo que ciertos rasgos cambien juntos sin efectos negativos en otros módulos.
Lectura recomendada
Brun-Usan, M., Rago, A., Thies, C., Uller, T., & Watson, R. A. (2020). Developmental models reveal the role of phenotypic plasticity in explaining genetic evolvability. bioRxiv, 2020-06.
Wagner, G. P., & Zhang, J. (2011). The pleiotropic structure of the genotype–phenotype map: the evolvability of complex organisms. Nature Reviews Genetics, 12(3), 204-213.
4.2.2.11.9 Evolucionabilidad y macroevolución
Los biólogos utilizan varios conceptos de “evolucionabilidad” que, aunque diferentes, están interrelacionados y se superponen. Estos conceptos van desde nociones sobre la heredabilidad (la capacidad de transferir variaciones genéticas de una generación a otra) hasta ideas especulativas sobre los factores que podrían haber permitido grandes innovaciones evolutivas. Entre estos extremos, el enfoque más común entiende la evolucionabilidad como una propiedad de la arquitectura genética y los sistemas de desarrollo que facilita la evolución adaptativa de fenotipos. Estos conceptos de evolucionabilidad abarcan distintas escalas de tiempo: desde generaciones sucesivas (dentro de poblaciones o especies), pasando por eventos filogenéticos a mediano plazo (evolución dentro de especies y clados), hasta eventos raros que posiblemente solo ocurrieron una vez en la historia de la vida, como las grandes transiciones evolutivas en clados. En lugar de ser un concepto único que se amplía o reduce según la escala, estos enfoques representan una familia de ideas relacionadas pero distintas que en conjunto abarcan el concepto de evolucionabilidad (Fig. 4.22).
Figura 4.31: El espectro conceptual de la evolucionabilidad. Imagen tomada de Pigliucci (2008).
En el contexto macroevolutivo, el análisis de la evolucionabilidad se centra en especies y clados. Desde esta perspectiva, es importante investigar si (a) las especies y clados presentan variaciones en su capacidad intrínseca de evolucionar, (b) qué factores determinan esa variación, y (c) si esas diferencias se mantienen a lo largo de la historia de un clado.
Asimismo, se plantea una pregunta fundamental: ¿los mecanismos genéticos y de desarrollo que favorecen la evolucionabilidad a corto plazo también tienen efectos predecibles a gran escala y a largo plazo en la evolución? Si existen diferencias de evolucionabilidad entre clados, podría incluso explorarse si estas diferencias afectan la supervivencia y reproducción de clados enteros, lo que permitiría una selección entre clados en función de su evolucionabilidad. Sin embargo, este enfoque es complicado, ya que a estas escalas macroevolutivas generalmente se cuenta solo con evidencia indirecta.
La investigación en este campo busca identificar rasgos intrínsecos que puedan influir en la capacidad evolutiva de los clados y observar cómo varía la evolucionabilidad en diferentes contextos temporales y espaciales. Aunque aún no hay respuestas definitivas, este enfoque macroevolutivo tiene el objetivo de estructurar preguntas y ejemplos que puedan fomentar futuras investigaciones teóricas y empíricas sobre la evolucionabilidad a nivel de clados.
4.2.2.11.9.1 Aplicando el Concepto de Evolucionabilidad en Macroevolución
El concepto de evolucionabilidad en macroevolución podría abarcar varios aspectos, como la diversidad taxonómica, la variedad funcional o la disparidad morfológica. Sin embargo, muchos investigadores prefieren restringir este término a la capacidad fenotípica de responder a oportunidades evolutivas, es decir, a cambios en el espacio morfofuncional que permitan adaptaciones significativas. La capacidad de una especie o clado para aprovechar estas oportunidades puede depender tanto de factores internos, como la adquisición de nuevas estructuras o vías de desarrollo, como de factores externos, como la entrada en nuevos ecosistemas o la supervivencia a eventos de extinción masiva.
Para evaluar la evolucionabilidad en un contexto macroevolutivo, se pueden observar los movimientos de clados en el espacio morfológico o morfofuncional a lo largo del tiempo. Este análisis ayuda a identificar cómo ciertos clados logran una expansión significativa en términos de diversidad de formas o funciones, mientras que otros presentan cambios menos notables. La evaluación de la evolucionabilidad en clados extintos o actuales permite comparar cómo respondieron a oportunidades evolutivas similares, aunque es importante reconocer que cada grupo experimenta su entorno de manera única, lo que complica el análisis.
Otra perspectiva relevante sobre evolucionabilidad es cómo ciertos clados pueden atravesar limitaciones en la variabilidad fenotípica a través de la homoplasia, que es cuando se observa una convergencia en caracteres entre linajes no relacionados. Aunque este fenómeno puede indicar una cierta limitación en la capacidad de los organismos para generar nuevas variaciones, también sugiere que algunos clados podrían alcanzar un tope en su capacidad evolutiva, especialmente en términos de adquisición de nuevos estados de caracteres. Esto resulta en una menor evolucionabilidad cuando se mide en términos de captación de nuevos estados en un contexto macroevolutivo, aunque aún puede haber variabilidad significativa en un rango de formas limitado.
El análisis de la evolucionabilidad en macroevolución implica un balance entre los factores intrínsecos, como la estructura genética y los mecanismos de desarrollo, y los factores extrínsecos, como el entorno y las oportunidades evolutivas. A pesar de los desafíos para integrar datos de registros fósiles y estudios de organismos actuales, ambos enfoques ofrecen perspectivas valiosas para comprender cómo la evolucionabilidad ha moldeado la historia de la vida en la Tierra.
4.2.2.11.9.2 Observaciones en organismos actuales
Se ha sugerido un enfoque neontológico que mide las características de poblaciones actuales para evaluar cómo estas podrían reflejar distintos niveles de evolucionabilidad en rasgos o clados, es decir a niveles macroevolutivos. Luego, se prueba la validez de estas estimaciones de manera retrospectiva, es decir, analizando los resultados macroevolutivos o la dinámica estimada de estos rasgos o clados a lo largo del tiempo. Algunos estudios relevantes incluyen comparaciones entre primates y carnívoros, rumiantes y Drosophila. Sin embargo, tales análisis requieren suposiciones fuertes, a menudo poco comprendidas, como la estabilidad de las matrices genéticas (que describen las covarianzas genéticas vinculadas a fenotipos, es decir cómo las variaciones genéticas en un conjunto de rasgos están relacionadas entre sí) en escalas temporales extensas. Esto se complica aún más debido a las relaciones complejas y no lineales entre genotipo y fenotipo (pleiotropía y epistasis). Además, la integración de fósiles mejora significativamente la precisión de los modelos evolutivos, revelando diversidades morfológicas extintas que enriquecen la comprensión de la evolución de los clados. Ejemplos incluyen especies actuales y extintas, como artrópodos cámbricos y cangrejos de herradura, que muestran cómo formas antiguas ampliaron el morfoespacio más allá de lo que observamos hoy.
4.2.2.11.9.3 Observaciones en el registro fósil
Los análisis paleontológicos sobre la evolucionabilidad enfrentan diversos desafíos, principalmente debido a los sesgos de muestreo y preservación de los fósiles. Estos sesgos pueden distorsionar o incluso crear patrones que no existían originalmente. Sin embargo, con el tiempo se han desarrollado métodos para reducir estos efectos y mejorar la precisión de los datos. En los estudios paleontológicos, únicamente se dispone de información fenotípica post-embrionaria, lo cual limita el análisis directo de las bases genéticas y de desarrollo. Por lo tanto, las causas de las diferencias en comportamiento entre clados deben inferirse indirectamente.
Un aspecto relevante es la evaluación de los vacíos en el espacio morfológico (morfoespacio) de un clado, es decir, aquellos rasgos o formas que no aparecen en el registro fósil de ciertos grupos. Estos vacíos pueden deberse a una limitación en la capacidad de desarrollo de los clados, lo que les impide explotar ciertas oportunidades evolutivas, o a factores externos como la competencia. En algunos casos, esos vacíos podrían reflejar la extinción de especies en nichos específicos, que luego no han sido ocupados de nuevo debido a la falta de tiempo evolutivo.
Otro factor importante es el papel de las interacciones ecológicas en la evolución. Las interacciones negativas, como la depredación y el parasitismo, pueden restringir la diversidad fenotípica y taxonómica en ciertos clados, mientras que las interacciones positivas, como el mutualismo, pueden facilitar la diversificación aunque, en algunos casos, también pueden aumentar las probabilidades de extinción si el destino de las especies involucradas se vuelve interdependiente.
Además, aunque a nivel macroevolutivo la competencia directa entre clados y el desplazamiento competitivo parece relativamente rara a grandes escalas temporales, los efectos de especies incumbentes o “efectos de prioridad” parecen más comunes, donde los clados que colonizaron un área primero ocupan y estabilizan ciertas zonas del espacio morfológico, dificultando la entrada de nuevos competidores. Por ejemplo, el primer grupo en diversificarse en un ecosistema puede establecerse en nichos claves, dificultando que otros grupos ocupen esos mismos espacios.
A pesar de estas complicaciones, los estudios paleontológicos proporcionan información crucial sobre las diferencias en la evolucionabilidad entre clados y a través del tiempo, sugiriendo que algunos grupos tienen una mayor capacidad de adaptación y diversificación en respuesta a oportunidades evolutivas. Estas diferencias, junto con factores externos como la competencia y los efectos de incumbencia, pueden tener consecuencias macroevolutivas significativas en la historia de la vida en la Tierra.
4.2.2.11.9.4 Factores que incrementan la evolucionabilidad de los clados
4.2.2.11.9.4.1 Modularidad y tipo de reproducción
La modularidad, entendida como la capacidad de ciertos conjuntos de genes y rasgos para variar de manera relativamente independiente, es uno de los factores más asociados a la evolucionabilidad. Sin embargo, existen distintos tipos de módulos —funcionales, de desarrollo, genéticos, evolutivos— y no está claro cómo se relacionan entre sí. Aunque se ha propuesto que una mayor modularidad favorece la evolucionabilidad al permitir que diferentes rasgos cambien sin afectar a otros, los resultados en estudios macroevolutivos no siempre respaldan esta relación de manera consistente. Para que la modularidad impulse la evolucionabilidad, la estructura de los módulos debe ser compatible con las presiones de selección externa, lo cual no siempre ocurre. Esto hace que las predicciones a largo plazo sean difíciles, aunque observar el papel de la modularidad en casos específicos ofrece valiosos conocimientos.
Por ejemplo, los artrópodos son particularmente buenos en aprovechar la modularidad tanto a nivel morfológico como molecular. Este grupo es capaz de desarrollar estructuras nuevas, como alas o pigmentación en nuevas áreas del cuerpo, gracias a su capacidad para reutilizar vías de desarrollo. En comparación, los tetrápodos están más limitados en cuanto a la formación de nuevas estructuras debido a una menor modularidad en sus genes de desarrollo.
La dimensionalidad de la forma también está relacionada con la evolucionabilidad. Clados con una mayor cantidad de componentes independientes tienen más opciones de cambio y, por tanto, mayor potencial evolutivo. Sin embargo, demasiada modularidad puede obstaculizar la evolución si se requieren múltiples mutaciones pequeñas para afectar a cada rasgo de forma independiente, mientras que una modularidad insuficiente (alta integración) puede hacer que cualquier cambio afecte a demasiados rasgos, limitando la variación favorable.
La covariación entre rasgos, o integración morfológica, puede en algunos casos facilitar una evolución más rápida y extensa si la selección actúa en las direcciones facilitadas por esta estructura integrada. Es decir, en algunos casos, la integración podría ser más beneficiosa para la evolucionabilidad que la modularidad, especialmente si permite variaciones dentro de un rango específico en el espacio morfológico. Esto sugiere que la evolucionabilidad de un clado puede cambiar a lo largo del tiempo debido a la variabilidad en la integración y estructura de covariación de los rasgos.
La simplicidad en el desarrollo, como la observada en la diversificación del pico de las aves, puede favorecer una mayor evolucionabilidad. Esto se debe a que menos restricciones en las bases de desarrollo permiten más variabilidad morfológica. Por ejemplo, el pico de las aves muestra una evolución modular desde el Cretácico, lo cual ha facilitado su diversificación.
Las estructuras esqueléticas articuladas, como las de vertebrados y artrópodos, pueden aumentar la evolucionabilidad al permitir un mayor control en el desarrollo y en la interacción de múltiples elementos de manera independiente. Esta “modularidad espacial” facilita la evolución de formas y funciones diversas sin afectar de manera significativa a otras partes del organismo. En los moluscos, por ejemplo, esta modularidad permite a los caparazones desarrollar una amplia gama de formas y patrones ornamentales, lo que aumenta su capacidad de variación y adaptación en respuesta a distintas presiones ambientales, promoviendo una notable diversidad morfológica.
En organismos que se reproducen de manera clonal, como ciertos animales coloniales y plantas, la modularidad adquiere un nuevo nivel, ya que cada clon o zoide puede actuar como un módulo evolutivo. Esto permite que mutaciones somáticas se acumulen en zoides individuales, generando variaciones dentro de la colonia que incrementan la variabilidad genética y, potencialmente, la evolucionabilidad del clado.
La reproducción sexual, ampliamente prevalente en eucariotas, contribuye a la evolucionabilidad al promover la generación continua de nuevas combinaciones genéticas. La hipótesis de la Reina Roja podría explicar el mantenimiento de la reproducción sexual, por ejemplo, mediante la presión por parásitos para la producción continua de fenotipos novedosos. Se ha propuesto que esta capacidad de generación de variantes fenotípicas sea favorecida a nivel macroevolutivo, aunque este tipo de hipótesis todavía debe ser probado de manera exhaustiva.
En conclusión, la modularidad y la estructura de covariación de los rasgos, junto con el tipo de reproducción, son factores críticos que influyen en la capacidad evolutiva de los clados. La comprensión de estas interacciones y sus efectos en la macroevolución aún presenta desafíos, pero ofrece un campo de investigación prometedor para integrar datos paleontológicos y actuales.
4.2.2.11.9.4.2 Alometría ontogenética o ciclos de vida con fases múltiples
La alometría ontogenética (cambios en la forma durante el desarrollo) y los ciclos de vida con fases múltiples pueden aumentar la evolucionabilidad en ciertos linajes. La integración fenotípica a lo largo del desarrollo, es decir, la tendencia de ciertos rasgos a variar de forma coordinada y viable, puede facilitar cambios evolutivos rápidos si está alineada con la selección natural. Este concepto se vuelve particularmente relevante en los clados que experimentan cambios significativos de forma a lo largo del desarrollo ontogenético o en aquellos con ciclos de vida complejos, donde la variación de forma a lo largo del desarrollo puede ayudar a ampliar el espacio morfológico disponible. En estos casos, fonómenos de heterocronía pueden llevar a cambios morfológicos drásticos en escalas temporales reducidas, facilitando que ciertos linajes accedan a una mayor diversidad de formas y funciones, y ocupen nichos ecológicos distintos. Estos cambios morfológicos pueden ser contínuos en casos de cados con alometría ontogenética o discontínuos en clados con ciclos de vida con fases múltiples y ambos están bien documentados.
Respecto a los primeros, se han identificado tendencias de cambio direccional en el registro fósil, como las llamadas pedomorfoclinas y peramorfoclinas, que representan transiciones hacia estados pedomórficos (“juveniles”) y peramórficos (“exagerados”), respectivamente, lo cual puede indicar una evolucionabilidad en direcciones específicas. Esto sugiere que algunas especies siguen patrones de cambio evolutivo predecibles a lo largo del tiempo, probablemente influenciados por sus trayectorias ontogenéticas ancestrales. Estas observaciones reflejan cómo la ontogenia puede guiar la evolución hacia trayectorias de variación morfológica particulares, proporcionando una base evolutiva para la diversificación en ciertos linajes y destacando el rol de la heterocronía y la alometría ontogenética en la expansión del morfoespacio de los clados a lo largo del tiempo.
Respecto a los segundos, la frecuencia con la que los rasgos larvales se retienen en fenotipos adultos mediante heterocronía no es clara, salvo en el caso de algunas salamandras. En algunos pocos invertebrados marinos se observan la transferencia de rasgos larvales a la fase adulta, mientras que en otros se observa el patrón contrario. Los insectos que pasan por una metamorfosis completa también podrían considerarse bajo esta perspectiva, aunque la metamorfosis es un evento tan extremo en el desarrollo de los insectos que es poco probable que los caracteres larvales se mantengan en los adultos y viceversa. Al igual que en el caso de las salamandras y las ranas, los insectos hemimetábolos pueden tener más probabilidades de depender de sus trayectorias ontogenéticas, pero quizás también el margen de variación morfológica sea más limitado en comparación con los insectos holometábolos.
Otro aspecto interesante es cómo los patrones de alometría ontogenética pueden perder su influencia con el tiempo, como se ha observado en algunos peces óseos. Esto sugiere que las trayectorias de desarrollo inicialmente integradas pueden volverse menos limitantes en escalas de tiempo evolutivas, lo cual abre la puerta a una mayor variación.
4.2.2.11.9.4.3 Caracteres novedosos
Nuevos rasgos pueden aumentar la evolucionabilidad de los clados, ya que permiten acceder a nuevos entornos adaptativos y a un mayor rango de variación. Ejemplos claros incluyen la aparición de extremidades, pulmones o el huevo amniótico, que expandieron la diversidad morfológica y funcional de los clados que los poseen. Sin embargo, son pocos los casos donde un nuevo rasgo se asocia directamente con una rápida diversificación del clado, pues a menudo estos “rasgos clave” forman parte de una cadena de caracteres derivados o dependen de eventos externos, como oportunidades ecológicas. Esto se observa en los “retardos macroevolutivos”, donde la aparición de un nuevo rasgo o clado ocurre mucho antes de su diversificación.
El estudio de estos retardos puede ayudar a comprender cómo factores internos y externos influyen en la evolucionabilidad de un clado. En algunos casos, la diversificación parece estar asociada a la recuperación de extinciones masivas, mientras que en otros involucra rasgos fenotípicos que promueven la diversificación por sí mismos. Por ejemplo, en mamíferos, aunque las vértebras cervicales están limitadas en número, este mismo rasgo ha sido superado en ciertos dinosaurios y aves, permitiendo una mayor variación en la longitud del cuello.
La rotura de la simetría bilateral también se ha relacionado con la evolucionabilidad. Por ejemplo, los bivalvos como las ostras y los ostreidos han desarrollado conchas asimétricas que podrían haber aumentado su capacidad de diversificación en respuesta a oportunidades o presiones ecológicas. Igualmente, la transición de simetría radial a bilateral en erizos irregulares permitió que estos últimos exploraran un rango mayor en el espacio morfológico en comparación con los erizos regulares, quienes evolucionaron en un espacio morfológico más limitado (Fig. 4.32).
Figura 4.32: Diferencias en la evolucionabilidad aparente en los principales clados de erizos de mar, representadas en un filomorfospacio basado en un análisis de coordenadas principales de una matriz de caracteres. Imagen tomada de Jablonski (2022).
Los “clados zombis” o “dead-clade-walking” son clados que, tras eventos de extinción, persisten sin diversificarse, sugiriendo una pérdida de evolucionabilidad, posiblemente debido a la falta de ciertos rasgos o condiciones que promuevan su diversificación. Esto contrasta con los clados que logran diversificarse tras un evento de extinción, indicando que algunos factores intrínsecos o extrínsecos les otorgan una ventaja evolutiva (Fig. 4.33).
Figura 4.33: Rangos de 70 clados de órdenes considerados como clados zombis a nivel de orden. Las líneas gruesas y claras representan la duración de vida del orden antes del evento de disminución de diversidad (DS); las líneas delgadas y oscuras se extienden desde el DS de cada clado hasta su última aparición registrada (LAD), cada una trazada utilizando la edad del límite inferior de la etapa. Las barras grises marcan las etapas asociadas con los cinco grandes eventos de extinción masiva considerados. Imagen tomada de Barnes et al. (2021).
Algunos modos de vida, como la hipercarnivoría o la reproducción uniparental, pueden reducir la capacidad evolutiva de un grupo al implicar compromisos difíciles de revertir. Estos compromisos podrían deberse a la especialización extrema de ciertos rasgos, lo que restringe las oportunidades de adaptación y diversificación futuras.
4.2.2.11.9.4.4 Tamaño del genoma
El tamaño del genoma y las duplicaciones completas del genoma (WGD), especialmente en plantas, se asocian con la capacidad evolutiva. Las duplicaciones completas del genoma, a menudo relacionadas con la hibridación interespecífica y la alopoliploidía, permiten combinar fenotipos parentales y generar rasgos novedosos. Los clados de plantas con más eventos de duplicación del genoma ocupan un mayor espacio morfológico. Por lo que respecta a animales, el rol macroevolutivo del tamaño del genoma y de las WGD es menos claro. Aunque se han vinculado antiguas duplicaciones del genoma con diversificaciones tempranas en vertebrados e invertebrados, aún se necesita evidencia más directa para entender cómo estas duplicaciones han influido en la evolución morfológica y taxonómica en el tiempo. En hongos, no existe relación entre WGD y evolucionailidad.
4.2.2.11.9.4.5 Complejidad
La relación entre la complejidad y la evolucionabilidad es un tema complejo que ha suscitado debate en la biología evolutiva. Tradicionalmente, se pensaba que a medida que los organismos se vuelven más complejos, su capacidad de adaptación disminuye, lo que se ha denominado “costo de la complejidad”. Este concepto parte del modelo geométrico de adaptación, que sugiere que cuando muchos rasgos están sometidos a selección correlacional (es decir, varios rasgos se seleccionan simultáneamente), la adaptación se vuelve más lenta en organismos complejos. Sin embargo, este modelo no considera directamente la complejidad del organismo en sí, sino el número de rasgos sujetos a selección.
Un factor importante en esta relación es la modularidad, que se refiere a la capacidad de dividir a un organismo en “módulos” o unidades funcionales relativamente independientes. Cuando estos módulos están alineados con los patrones de selección, la modularidad permite optimizar múltiples rasgos simultáneamente, mejorando la evolucionabilidad. Pero, si esta alineación no se da, la modularidad puede dificultar la adaptación. Además, la canalización, o la limitación de los efectos pleiotrópicos (cuando un gen afecta a varios rasgos), reduce la capacidad evolutiva al restringir la variabilidad.
Es importante destacar que la modularidad y la integración pueden evolucionar no solo por selección natural, sino también por mecanismos no selectivos, como la deriva genética, los efectos secundarios de la evolución de ciertos rasgos o las restricciones del desarrollo. Esto implica que la modularidad puede surgir sin necesariamente favorecer la evolucionabilidad. A pesar de su atractivo conceptual, el impacto real de la modularidad en la capacidad de evolución sigue siendo modesto y aún no se ha cuantificado de forma sistemática.
Los patrones de evolución suelen coincidir con los patrones de variación dentro de las poblaciones, aunque estos pueden ser explicados tanto por selección natural como por limitaciones en las variaciones posibles, conocidas como restricciones variacionales. Sin embargo, aún se sabe poco sobre si la modularidad y la integración están siempre alineadas con los patrones de selección natural, y hay poca información para comparar los patrones de selección con los datos de variación dentro o entre poblaciones.
Desde el punto de vista de los paisajes adaptativos, los modelos genéticos sugieren que los genomas con alta dimensionalidad (con muchos genes) son menos propensos a tener genotipos de alta aptitud como picos aislados en el paisaje adaptativo. En cambio, los genotipos de alta aptitud tienden a tener “vecinos” de aptitud similar, lo cual facilita la evolución hacia nuevas adaptaciones.
Además, la innovación evolutiva puede modificar la estructura genética y fenotípica, alterando la forma del paisaje adaptativo y permitiendo una mayor variabilidad en el fenotipo al ampliar el “tamaño del blanco mutacional”, o las posibilidades de variación genética.
En conclusión, no existe una respuesta definitiva sobre si la complejidad favorece o limita la evolucionabilidad. La respuesta depende en gran medida de los rasgos específicos en consideración y de la naturaleza de la selección natural que opera en cada contexto. Entender esta relación entre complejidad y capacidad evolutiva es un desafío, y se necesitan estudios más profundos para comprender cómo actúa realmente la selección en diferentes entornos y en diferentes niveles de complejidad.
4.2.2.11.9.4.6 Rasgos evolucionables
Los rasgos individuales pueden diferir en su capacidad evolutiva y, en algunos casos, contribuyen a que el linaje al que pertenecen se expanda en términos de rango morfológico o funcional. Sin embargo, la “carga” de desarrollo o “anclaje” de algunos rasgos—donde otros rasgos dependen del desarrollo de uno en particular—puede limitar su capacidad de evolucionar. Este concepto ha sido explorado mediante la posición de rasgos en redes genéticas, con la idea de que los rasgos controlados por genes en posiciones terminales de estas redes deberían tener mayor libertad evolutiva que aquellos controlados en niveles más altos. Aunque esta idea es atractiva, resulta difícil de sostener debido a la complejidad de los sistemas genéticos y las interacciones de los genes en múltiples niveles, que pueden permitir la conservación de redes sin limitar directamente la capacidad evolutiva fenotípica.
La modularidad del desarrollo también juega un rol importante en la evolucionabilidad de los rasgos. Los sistemas de desarrollo organizados en módulos permiten que ciertos rasgos evolucionen de manera más independiente, lo que podría ayudar a sortear limitaciones de evolución impuestas por rasgos integrados en el desarrollo. Este fenómeno se ha observado, por ejemplo, en el desarrollo de los dientes en mamíferos, donde pequeñas alteraciones en los factores reguladores de los módulos del desarrollo producen cambios significativos en la forma dental.
La plasticidad fenotípica es otro atributo que puede favorecer la evolucionabilidad de los rasgos. La capacidad de un organismo para generar distintos fenotipos en respuesta a cambios ambientales podría ampliar las posibilidades evolutivas a través de la asimilación o acomodación genética de rasgos alternativos. Sin embargo, la plasticidad no siempre es adaptativa y puede volverse desventajosa en entornos altamente impredecibles. Además, la plasticidad depende de señales ambientales, lo que significa que si esta tiene un papel importante en la macroevolución, entonces los cambios en el entorno a lo largo del tiempo y en grandes áreas, como las expansiones geográficas, podrían influir en la capacidad evolutiva de un linaje (por ejemplo, si nuevas poblaciones se mueven a areas con características ambientales fuera del rango habitual al que están adaptadas).
Finalmente, los roles funcionales de los rasgos también pueden influir en su capacidad evolutiva. Rasgos que presentan compromisos entre múltiples funciones pueden ser menos evolutivos en comparación con aquellos con roles más especializados, como se ha visto en los caparazones de tortugas acuáticas, que deben resistir cargas y reducir la resistencia al agua, en comparación con los caparazones de tortugas terrestres.
4.2.2.11.9.4.7 Tasa de especiación
A lo largo de las escalas geológicas, muchas especies tienden a mantenerse estables en su morfología o presentan cambios sin dirección clara. Esto le otorga un papel relevante a la especiación en la ocupación de morfoespacio en varios clados, es decir, en cómo exploran nuevas formas y funciones. Aunque algunos investigadores consideran que las tasas elevadas de especiación son un signo de evolucionabilidad, se ha debatido esta idea, ya que la especiación en sí no siempre implica diversificación morfológica o funcional (Fig. 4.34).
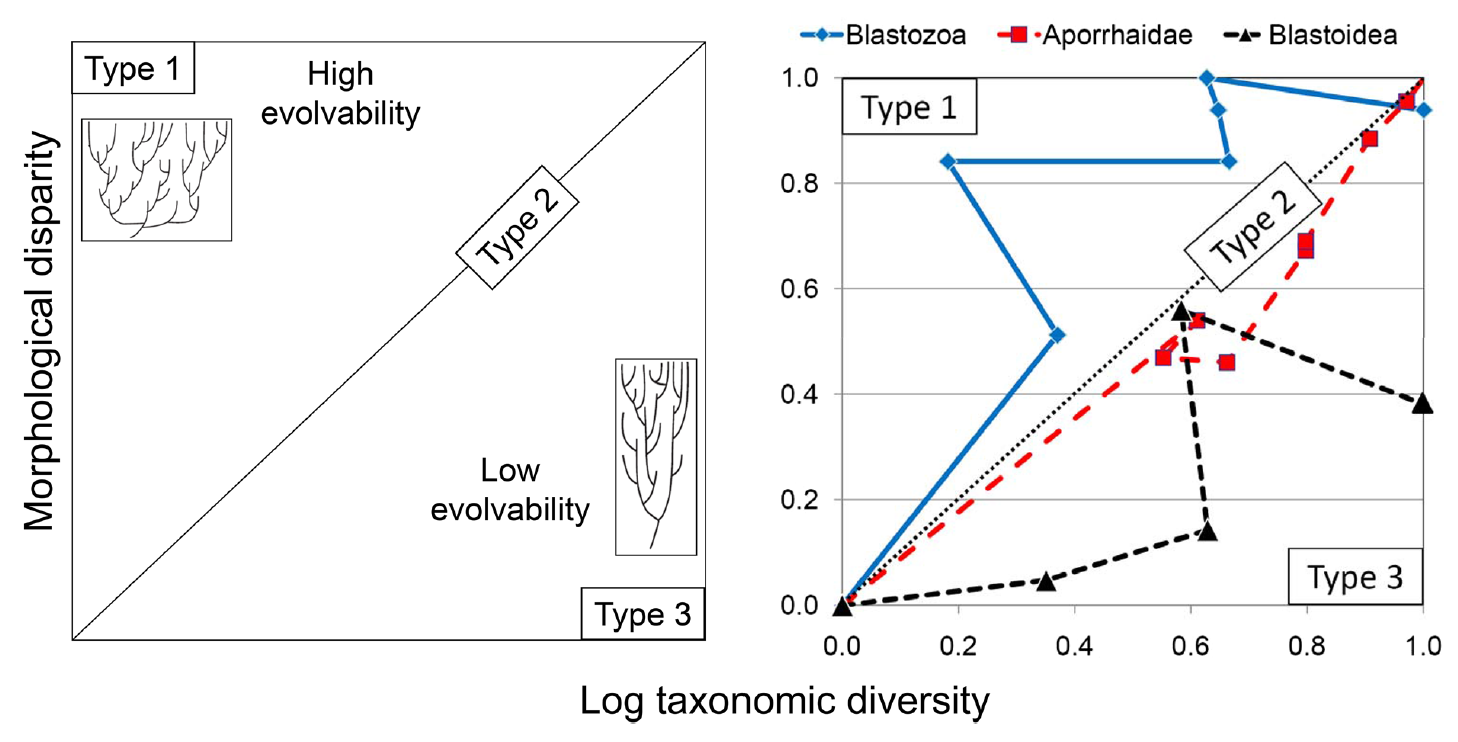
Figura 4.34: Evolución en el espacio de diversidad-disparidad. Izquierda: Tipo 1. La disparidad supera la diversificación taxonómica, Tipo 2. La disparidad está en concordancia con la diversificación taxonómica, Tipo 3. La disparidad queda rezagada respecto a la diversificación taxonómica. Derecha: tres trayectorias empíricas para los equinodermos blastozoos del Cámbrico-Ordovícico, los gasterópodos aporrhaidos del Jurásico-Cretácico, y los equinodermos blastoideos del Ordovícico-Carbonífero. Imagen tomada de Jablonski (2022).
Se observan tres factores principales en cómo la especiación afecta la evolucionabilidad. Primero, la especiación puede estar alineada con la variación fenotípica existente dentro de una especie, facilitando el movimiento en ciertas direcciones evolutivas. Los clados con altas tasas de especiación tienden a explorar el morfoespacio más rápido, especialmente si la variación fenotípica ya predispone ciertos cambios, aunque la influencia de esta variación disminuye con el tiempo o debido a eventos externos, como cambios climáticos. Segundo, las altas tasas de especiación pueden permitir que ciertos rasgos “viajen” junto a aquellos que incrementan la tasa de especiación, promoviendo la proliferación de estos rasgos en el clado. Esto puede significar que la evolucionabilidad aparente de un rasgo puede ser impulsada indirectamente por la especiación, en lugar de por selección directa sobre el rasgo en sí. Tercero, clados con alta especiación generan más “experimentos fenotípicos”, aumentando la duración del clado y su tiempo para explorar el morfoespacio. Sin embargo, la alta especiación no siempre garantiza la expansión morfológica, ya que existen casos documentados donde las altas tasas de especiación no generan una expansión correspondiente en el morfoespacio.
Además, las altas tasas de especiación a menudo vienen acompañadas de un “compromiso macroevolutivo”: los mismos rasgos que promueven la especiación también pueden elevar la tasa de extinción. Por ejemplo, una baja capacidad de dispersión puede incrementar la especiación, pero también limitar el rango geográfico de las especies, lo que aumenta el riesgo de extinción. Esta volatilidad en clados de alta especiación puede reducir el tiempo disponible para explorar o expandirse en el morfoespacio.
Por lo tanto, los clados con mayor evolucionabilidad tienden a ser aquellos que exploran más el morfoespacio en relación con sus tasas de especiación. Este equilibrio puede visualizarse en el análisis de diversidad-disparidad, donde ciertos clados muestran una expansión morfológica inicial seguida de una estabilización, mientras que otros mantienen una diversificación proporcional a su crecimiento taxonómico.
4.2.2.11.9.5 Evolucionabilidad y riesgo de extinción
La evolucionabilidad se ha enfocado principalmente en cómo afecta las tasas de aparición de nuevas especies o la generación de nuevas morfologías. Sin embargo, este concepto también puede vincularse con la capacidad de un clado para adaptarse a cambios ambientales y reducir su riesgo de extinción. Es decir, los linajes que pueden generar una mayor variación fenotípica pueden tener mejores probabilidades de supervivencia al enfrentar condiciones cambiantes.
A nivel de especies, se sugiere que una mayor evolucionabilidad podría aumentar la tasa de supervivencia en poblaciones amenazadas por factores antropogénicos, ya que podría permitir una respuesta adaptativa rápida. Esto también es relevante en el caso de las especies incipientes, aquellas en las primeras etapas de divergencia evolutiva, ya que una alta evolucionabilidad podría facilitar la adquisición de aislamiento reproductivo o la divergencia morfológica cuando poblaciones espacialmente separadas vuelven a coexistir. Este tipo de especiación, conocida como especiación ecológica, es fundamental en clados donde la persistencia de estas especies incipientes puede ser crucial para el inicio de eventos de diversificación. Los paleontólogos, sin embargo, enfrentan limitaciones para estudiar especies incipientes en el registro fósil, ya que estas fases de la evolución son efímeras y difíciles de rastrear. Un modelo para abordar esto sería analizar si la formación de estas especies está inversamente relacionada con la capacidad de dispersión, y si su capacidad de persistir bajo condiciones de coexistencia con especies emparentadas depende de la evolucionabilidad.
A nivel de clado, la persistencia de un grupo en el tiempo también podría depender de su capacidad evolutiva. Por ejemplo, algunos estudios sugieren que especies con mayor variación fenotípica pueden tener una duración de vida más prolongada. No obstante, existen excepciones: los trilobites del Cámbrico, por ejemplo, muestran que las especies con menor variación morfológica y mayor rango geográfico también pueden tener una duración prolongada. Esta observación sugiere que, en ciertos casos, una evolución morfológica rápida y la variabilidad resultante pueden caracterizar a especies de corta duración.
En los análisis de morfoespacio, que estudian la gama de formas y funciones ocupadas por un clado, se examina cómo la extinción afecta el alcance de este espacio, pero rara vez se investiga si una ocupación mayor del morfoespacio reduce el riesgo de extinción. Las evidencias en este sentido no son concluyentes: algunos estudios muestran que los clados con diversidad funcional tienen más resistencia a la extinción que los clados con poca diversidad funcional, pero otros hallazgos no respaldan una relación clara entre amplitud morfológica y duración del clado. Además, los llamados “fósiles vivientes” —clados de baja diversidad y baja disparidad (diferenciación morfológica)— sugieren que la persistencia a largo plazo no necesariamente requiere de una gran ocupación del morfoespacio.
También se ha propuesto que ciertos linajes que ocupan los límites del morfoespacio (outliers morfológicos) son más vulnerables a la extinción, lo que podría resultar en una contracción de diversidad y, a largo plazo, un aumento del riesgo de extinción de los clados más amplios. Sin embargo, aún faltan estudios que comparen directamente los riesgos de extinción entre clados con variación anisotrópica (orientada en una dirección específica) frente a variación isotrópica (equilibrada), lo cual podría ofrecer claves adicionales para entender cómo se relaciona la estructura de variación y la capacidad de evolución con la persistencia a lo largo del tiempo.
En conjunto, estos análisis resaltan que la evolucionabilidad podría no solo fomentar la diversificación, sino también fortalecer la resiliencia de un linaje frente a la extinción.
4.2.2.11.9.6 Relaciones espaciotemporales de la evolucionabilidad
La evolucionabilidad parece no ser constante a lo largo del tiempo y en distintas ubicaciones geográficas o ambientes ecológicos. Esta variabilidad temporal y espacial en la evolucionabilidad plantea preguntas clave sobre si son factores intrínsecos de los organismos o factores ambientales los que impulsan estas diferencias.
En términos temporales, uno de los ejemplos más notables es la explosión cámbrica. Durante este breve intervalo geológico (~20 millones de años), los metazoos experimentaron una rápida diversificación morfológica, que parece haber superado en velocidad y alcance a eventos posteriores. Este fenómeno sugiere que la evolucionabilidad de los organismos era particularmente alta en ese momento, lo que permitió que los metazoos ocuparan una amplia gama de formas y funciones. La pregunta sigue siendo si esta alta evolucionabilidad fue impulsada por factores intrínsecos (como innovaciones en la regulación genética) o por oportunidades ecológicas extrínsecas únicas de esa época. Aunque se ha propuesto que la aparición de una mayor capacidad de regulación genética facilitó este rápido cambio morfológico, muchos autores defienden una visión de “tormenta perfecta,” donde múltiples factores, tanto internos como externos, interactuaron para dar lugar a este evento de expansión morfológica.
Con el tiempo, esta rápida diversificación parece haberse desacelerado, un patrón que se ve reflejado también después de otras extinciones masivas, como la del Pérmico. A pesar de la pérdida significativa de diversidad taxonómica tras el evento Pérmico, la diversidad funcional no disminuyó de manera significativa, lo que sugiere que las oportunidades ecológicas tras este evento no eran comparables a las de la explosión cámbrica. Algunos estudios sugieren que el “llenado” de los hábitats marinos y la competencia en los ecosistemas fueron factores que limitaron nuevas expansiones evolutivas, ralentizando el ritmo de cambio morfológico en épocas posteriores.
A nivel taxonómico inferior, se ha observado que algunos clados parecen experimentar una mayor evolucionabilidad en sus etapas iniciales, cuando aún muestran una amplia variación en ciertos rasgos. Esta tendencia postula que los rasgos tienden a variar más en los primeros miembros de un clado, y menos en los posteriores, posiblemente debido a la estabilización de los sistemas de desarrollo con el tiempo. Esto sugiere que los clados a menudo ocupan la mayor parte de su “morfoespacio” al inicio de su historia, y después solo incrementan su diversidad de formas de manera limitada. Sin embargo, también es posible que los factores ambientales limiten la variación en estos clados a lo largo del tiempo, creando así una reducción en la evolucionabilidad. Para entender mejor estos patrones, se requiere una integración de estudios paleontológicos y filogenéticos para determinar si estos cambios se deben a una reducción intrínseca en la evolucionabilidad o a “efectos de saturación ecológica.”
Además, algunos estudios han sugerido el patrón contrario donde la evolucionabilidad podría aumentar en las ramas más jóvenes de los clados mayores, especialmente en los animales y plantas, debido a la presión selectiva para aliviar compromisos energéticos, lo que lleva a una mayor “versatilidad” evolutiva. Este fenómeno sugiere que los organismos más recientes dentro de un clado pueden explorar una mayor variedad de formas que sus ancestros, aunque este efecto necesita ser comprobado en diferentes contextos evolutivos.
En cuanto a patrones espaciales, se ha encontrado que los clados tienden a originarse y diversificarse más rápidamente en los trópicos, que son ricos en diversidad y en variedad de formas. La investigación sugiere que los trópicos actúan como motores de la biodiversidad, no solo en términos de la riqueza de especies sino también de la disparidad morfológica. Otro patrón espacial interesante se observa en los gradientes de profundidad marina. Los registros fósiles sugieren que muchos grupos de invertebrados marinos tienden a originarse en hábitats costeros someros, que están sujetos a mayores perturbaciones y cambios ambientales. Estos ambientes costeros parecen fomentar la aparición de innovaciones morfológicas, como se ha visto en equinoideos y algunos vertebrados primitivos. Estos patrones nos hacen plantearnos una serie de preguntas: ¿son estos patrones impulsados por factores intrínsecos o están promovidos por los gradientes ambientales externos que los definen? En otras palabras, ¿tienen los organismos, especies o clados que habitan ambientes cálidos y poco profundos propiedades que aumentan su capacidad evolutiva, seleccionadas indirectamente por esos entornos, o es que esos entornos en sí mismos fomentan directamente una mayor variación fenotípica?
Los datos sugieren que factores intrínsecos pueden influir en la velocidad y el alcance de la evolución morfológica y funcional a gran escala, aunque el desafío sigue siendo distinguir estos factores de los múltiples elementos extrínsecos que también podrían afectar el espacio morfológico de un clado. Para avanzar en esta área, los análisis comparativos entre clados, que miden su respuesta ante oportunidades compartidas, serán esenciales. Estos estudios ayudarían a conectar datos fósiles y actuales y podrían emplear herramientas filogenéticas para revelar patrones de evolucionabilidad en el tiempo geológico.
Lectura recomendada
Houle, D., & Rossoni, D. M. (2022). Complexity, evolvability, and the process of adaptation. Annual Review of Ecology, Evolution, and Systematics, 53(1), 137-159.
Jablonski, D. (2022). Evolvability and macroevolution: overview and synthesis. Evolutionary Biology, 49(3), 265-291.
4.2.2.11.10 Mecanismos generadores de diversidad
Una propuesta controvertida y en gran medida pasada por alto es la hipótesis reciente de la existencia de mecanismos regulados de generación de diversidad, conocidos como “Generadores de Diversidad” (DGs, por sus siglas en inglés). Esta idea, desarrollada principalmente en el contexto de la interacción patógeno-huésped o parásito-hospedador, desafía la visión convencional de que la diversidad es producto de cambios aleatorios sometidos únicamente a la selección natural. En cambio, los DGs sugieren que existen procesos activos dentro de los organismos que producen y mantienen variabilidad de una manera controlada, confiriéndoles una “evolucionabilidad adaptativa” (concepción debatida) que les permite responder y anticiparse a cambios en su entorno. Esta propuesta plantea que ciertos mecanismos internos han evolucionado precisamente para aumentar la capacidad adaptativa, permitiendo que los organismos generen diversidad de forma flexible y anticipativa.
4.2.2.11.10.1 Generación de diversidad genética en procariotas
La generación de diversidad en organismos procariotas es un proceso más complejo y dinámico de lo que podría pensarse en un principio, ya que no se limita a la acumulación de mutaciones aleatorias en el ADN. Los procariotas, especialmente las bacterias, han desarrollado una serie de mecanismos eficientes que les permiten adaptarse rápidamente a los cambios en el ambiente y a las presiones selectivas. Estos mecanismos incluyen la transferencia horizontal de genes (THG), una estrategia que rompe el molde de la transmisión vertical de genes de padres a hijos, permitiendo en su lugar el intercambio de material genético entre células no emparentadas y, en algunos casos, incluso entre distintas especies.
Entre los métodos de THG, encontramos varios procesos importantes:
Conjugación: En este proceso, una bacteria donadora transfiere directamente material genético a una bacteria receptora a través de una estructura llamada pilus. Este mecanismo permite que genes específicos, como aquellos que confieren resistencia a antibióticos, se diseminen rápidamente en una población bacteriana, favoreciendo la supervivencia de algunas cepas bajo condiciones de presión selectiva, como la presencia de antibióticos. Por ejemplo, bacterias como Escherichia coli pueden adquirir genes de resistencia de otras bacterias presentes en el mismo ambiente, como en el intestino humano, convirtiéndose en “superbacterias” difíciles de erradicar.
Transformación: Este proceso permite que las bacterias absorban fragmentos de ADN libre en su entorno, que generalmente provienen de otras células bacterianas que han muerto y liberado su material genético. La bacteria receptora puede incorporar este ADN a su propio genoma si encuentra que estos nuevos genes le otorgan una ventaja adaptativa. Un ejemplo de transformación ocurre en Streptococcus pneumoniae, que puede adquirir genes de resistencia y virulencia a partir del ADN de otras bacterias de la misma especie o de diferentes especies que han muerto en el ambiente.
Transducción: En este caso, los bacteriófagos (virus que infectan bacterias) actúan como vectores para transferir material genético entre bacterias. Durante su ciclo de infección, los bacteriófagos pueden incorporar fragmentos del ADN de una bacteria infectada y luego transferirlo a otra bacteria que infectan posteriormente. Este mecanismo ha sido clave para la diseminación de genes de resistencia a antibióticos y otros factores de virulencia en poblaciones bacterianas. Salmonella y Staphylococcus aureus son ejemplos de bacterias que pueden beneficiarse de la transducción para adquirir nuevas capacidades de defensa.
Islas genómicas: Muchas bacterias poseen grandes bloques de genes adquiridos, conocidos como islas genómicas, que contienen varios genes que confieren ventajas adaptativas. Estas islas genómicas suelen codificar para funciones específicas, como la resistencia a antibióticos, la producción de toxinas, o el uso de nuevas fuentes de nutrientes. Estas regiones pueden ser adquiridas por transferencia horizontal de genes y ser integradas en el genoma bacteriano, como ocurre en Vibrio cholerae, cuyo patógeno incluye islas genómicas que le permiten producir toxinas y sobrevivir en condiciones hostiles en el intestino humano.
Elementos genéticos móviles: Los plásmidos, transposones y otros elementos genéticos móviles son componentes clave en la generación de diversidad. Los plásmidos son fragmentos circulares de ADN que pueden replicarse independientemente y que a menudo contienen genes de resistencia o virulencia. Estos plásmidos pueden ser fácilmente compartidos entre bacterias a través de la conjugación. Por otro lado, los transposones son “genes saltarines” que pueden moverse de una parte del genoma a otra, facilitando la reestructuración genética y la adaptación a nuevas condiciones. Un ejemplo es el plásmido R plasmid, que se encuentra en varias bacterias patógenas y que contiene múltiples genes de resistencia a antibióticos.
Respuesta SOS: Las bacterias también pueden activar mecanismos de respuesta a daños en el ADN, conocidos como respuesta SOS, cuando se encuentran en condiciones de estrés extremo, como la exposición a antibióticos o agentes dañinos. Este mecanismo induce una mayor tasa de mutación en un intento de generar variabilidad genética que pueda ayudar a la población a sobrevivir. En Escherichia coli, por ejemplo, la activación de esta respuesta permite a la bacteria experimentar cambios rápidos en su ADN, acelerando la aparición de mutaciones beneficiosas.
En conjunto, estos mecanismos de generación de diversidad genética permiten a las bacterias adaptarse a un amplio rango de entornos hostiles y responder eficazmente a desafíos como la presencia de antibióticos, sistemas inmunológicos de los huéspedes, o condiciones ambientales extremas.
4.2.2.11.10.2 Adquisición y regulación de los generadores de diversidad
La adquisición y regulación de generadores de diversidad (DG) en organismos dependen de la intensidad de las presiones selectivas ambientales. En ambientes estables, los organismos suelen beneficiarse más de sistemas de baja diversidad, optimizados para condiciones constantes. Sin embargo, cuando las presiones ambientales son intensas y variables, los DG se activan más intensamente, permitiendo una generación rápida de variabilidad genética o fenotípica.
Este mecanismo de ajuste asegura que los organismos generen diversidad justo cuando es más necesario para adaptarse a cambios ambientales críticos. Esto es particularmente evidente en organismos como bacterias, que pueden modular su tasa de mutación en respuesta al estrés. Además, los DG también pueden estar regulados por factores internos del organismo, como el estado metabólico o el desarrollo celular, que interactúan con las condiciones externas.
En conjunto, esta capacidad de respuesta flexible ayuda a los organismos a equilibrar los costos de mantener una alta diversidad con la necesidad de adaptarse a condiciones cambiantes, destacando cómo la evolución ha favorecido sistemas que ajustan dinámicamente la generación de diversidad en función de las exigencias del ambiente.
4.2.2.11.10.3 Mecanismos generadores de diversidad genética anticipativos en eucariotas
En los eucariotas unicelulares, la frecuencia de transferencia horizontal de genes (THG) es difícil de cuantificar, aunque se ha observado que no es infrecuente entre bacterias y protistas, facilitada por la fagocitosis. En contraste, los eucariotas multicelulares han desarrollado tejidos especializados que protegen a las células germinales, limitando la THG. Aunque la THG en estos organismos no es nula (como se ve en genes de origen viral en metazoos), es mucho menos frecuente que en los procariotas y suele darse en casos excepcionales, a menudo relacionados con infecciones o la microbiota.
Una innovación clave en los eucariotas fue la meiosis, conservada entre ellos desde un ancestro común y crucial en la reproducción sexual. Esta es menos eficiente en comparación con la reproducción asexual, ya que implica procesos largos y complejos como el reconocimiento específico entre gametos, lo cual limita la mezcla genética a ciertos individuos y da lugar a especies con límites genéticos claros, a diferencia de las especies “difusas” de procariotas. Debido a estas restricciones, los nuevos genes en metazoos suelen surgir de duplicaciones de genes existentes. Sin embargo, la meiosis permite una optimización de la recombinación genética entre los genomas de los individuos, compensando así la menor diversidad genética.
En protistas y algunos metazoos simples como las esponjas y cnidarios, la reproducción y la sexualidad ocurren de forma independiente y suelen activarse en respuesta a condiciones ambientales estresantes, como ocurre con la THG en procariotas. En cambio, en metazoos superiores, la meiosis se integra directamente en el proceso reproductivo, pasando de ser un mecanismo reactivo en organismos simples a un mecanismo anticipativo en organismos multicelulares complejos.
4.2.2.11.10.4 Generadores de diversidad fenotípica heredable en eucariotas
En organismos multicelulares, la generación de diversidad adquirida y heredable es un fenómeno complejo y multifacético que ha captado poco interés hasta hace poco. Sin embargo, esta diversidad es crucial para entender cómo estos organismos responden y se adaptan colectivamente a las presiones ambientales.
Un claro ejemplo de generación de diversidad en organismos multicelulares es el sistema inmunológico adaptativo (AIS, por sus siglas en inglés), cuya evolución y beneficios siguen siendo objeto de debate. El AIS es capaz de generar una gran variedad de receptores antigénicos, permitiendo que el organismo reconozca y responda a una enorme diversidad de patógenos, incluso aquellos que nunca ha encontrado. Aunque producir esta diversidad implica costos significativos (como el riesgo de reacciones autoinmunes), el sistema ha sido mantenido en diversos linajes de metazoos, desde vertebrados sin mandíbulas hasta artrópodos. El repertorio de receptores en cada organismo es único, resultado de una combinación de factores genéticos, ambientales y microbiológicos, lo que hace que la respuesta inmunológica ante un mismo patógeno sea impredecible a nivel individual. Esta diversidad inmunológica reduce las probabilidades de que un patógeno pueda adaptarse y superar las defensas de todos los individuos en una población, creando un mecanismo anticipatorio que protege a la población como un todo.
Otro ejemplo de generador de diversidad en organismos multicelulares es la variación de la “personalidad” o conducta individual en animales, que a menudo se consideraba ruido en los estudios de psicología y ecología. Hoy en día, se reconoce que estas diferencias de comportamiento juegan un papel adaptativo a nivel poblacional. En mamíferos, por ejemplo, se ha encontrado que el cerebro presenta un mosaico genético debido a variaciones en el número de copias de cromosomas, aneuploidías y elementos transponibles que generan una “plasticidad genómica”. Esta diversidad genética en las neuronas puede explicar por qué incluso animales genéticamente idénticos, como gemelos monocigóticos, muestran diferencias conductuales significativas.
La memoria a largo plazo, tanto inmunológica como neuronal, también contribuye a esta diversidad. Cada individuo adquiere experiencias únicas que moldean sus respuestas futuras a estrés y otros estímulos ambientales. En el sistema inmunológico, por ejemplo, se ha comprobado que infecciones previas pueden influir profundamente en la respuesta ante patógenos no relacionados. Este efecto es facilitado por la “poli-especificidad” de los linfocitos de memoria T y B y por mecanismos de “inmunidad entrenada”. La memoria a largo plazo, entonces, no solo permite una respuesta más rápida ante amenazas previas, sino que introduce una imprevisibilidad adaptativa que es valiosa para la supervivencia poblacional.
Tanto el sistema inmunológico adaptativo como el sistema nervioso central son sistemas complejos que no solo generan diversidad individual sino que también cumplen otras funciones importantes para la supervivencia y adaptación de los organismos multicelulares. La hipótesis de que esta diversidad individual contribuye a la selección evolutiva de estos sistemas no excluye otros beneficios que estos sistemas puedan aportar.
4.2.2.11.10.5 Hipótesis de las Dos Reinas: generación de diversidad reactiva versus anticipativa
Como se ha mencionado antes, la actividad de algunos generadores de diversidad (DGs) parece activarse en respuesta al estrés ambiental. Estos DGs “reactivos” participan en una dinámica que se ha descrito como la “Reina Roja” o “carrera armamentista,” en la cual organismos y patógenos evolucionan continuamente en respuesta a las amenazas mutuas. De forma interesante, existen otros DGs, como los adquiridos por patógenos, que funcionan de manera constante (es decir, siempre activos) y ayudan al patógeno a evadir la respuesta inmune adaptativa del huésped, permitiendo que persistan a largo plazo dentro de este.
Además, ciertos DGs en los metazoos, como la reproducción sexual obligatoria, la generación de un repertorio inmune adaptativo y el mosaico neuronal, parecen funcionar independientemente de las condiciones ambientales, lo que los convierte en DGs “anticipativos.” Estos mecanismos se observan principalmente en animales multicelulares complejos (metazoos), lo cual sugiere que fueron seleccionados debido a ciertos retos específicos de estos organismos.
A diferencia de organismos como las bacterias, los metazoos presentan características de “selección K”, como ciclos de vida reproductivos largos y tamaños de población más reducidos, lo cual disminuye la probabilidad de que variaciones genéticas reactivas en células germinales generen adaptaciones fenotípicas rápidas en las poblaciones. Por ello, se sugiere que los DGs anticipativos han sido favorecidos en estos organismos complejos porque permiten superar estas limitaciones.
Como tributo a Leigh Van Valen y al escritor Lewis Carroll, el autor propone llamar a esta dinámica generada por los DGs anticipativos la dinámica de la “Reina Blanca,” en referencia a la famosa frase de la Reina Blanca en el libro A través del espejo: “A veces he creído hasta en seis cosas imposibles antes del desayuno.” Esta metáfora es adecuada porque los DGs anticipativos generan una diversidad fenotípica aleatoria que no es adaptativa a nivel individual (es decir, “cosas imposibles”) y anticipativa (como “antes del desayuno”).
4.2.2.11.10.6 Propiedades comunes de los generadores de diversidad
Los generadores de diversidad (DG) presentan propiedades comunes, a pesar de sus diferencias en origen y componentes:
Primero, aunque basados en mecanismos determinados y altamente regulados, los DG otorgan imprevisibilidad a los sistemas biológicos. Existen dos mecanismos principales: la generación aleatoria de diversidad genética (a nivel germinal o somático) y la memorización de experiencias pasadas. Por ejemplo, los sistemas CRISPR-Cas en procariotas responden a elementos genéticos externos, como los fagos, y crean una “inmunidad adquirida” al integrar nuevas secuencias en el genoma. De modo similar, en mamíferos, el repertorio de receptores antigénicos de cada individuo es impredecible debido a la reordenación aleatoria de los genes de los linfocitos y la integración de experiencias inmunitarias previas. Estos procesos introducen variabilidad y hacen que la respuesta del sistema inmune de cada individuo sea diferente, lo cual es ventajoso en una coevolución antagonista donde una adaptación completa de los parásitos a sus hospedadores es imposible.
En segundo lugar, los DG operan manipulando sistemas de control de interfaz, que regulan la interacción de los organismos con su entorno. Así, mecanismos como la transferencia horizontal de genes y la meiosis no solo permiten el intercambio genético, sino que también controlan con quién se realiza ese intercambio. Esto actúa como una forma de discriminación entre “lo propio” y “lo ajeno” a nivel genético, similar a cómo el sistema inmune adaptativo distingue entre microorganismos beneficiosos (microbiota) y patógenos. Este control de interfaz introduce variabilidad y protege los sistemas nucleares, como las vías metabólicas, que son fundamentales y altamente conservadas.
Finalmente, los DG favorecen la robustez frente a presiones selectivas, principalmente a nivel de población. Aunque son costosos y los beneficios a nivel individual pueden ser impredecibles, suelen generar ventajas casi garantizadas a nivel poblacional. Por ejemplo, la meiosis genera combinaciones genéticas nuevas, lo que resulta en fenotipos variados, y aunque algunos de estos pueden tener menor aptitud, el aumento de diversidad fenotípica fortalece a la población frente a epidemias y favorece la complementariedad genética, lo cual es ventajoso en un contexto poblacional.
4.2.2.11.10.7 ¿Hay seleccion sobre los generadores de diversidad?
La selección de Generadores de Diversidad (DG) durante la evolución plantea un problema fascinante y complejo que desafía las teorías convencionales sobre la selección de procesos cooperativos. Los DG, al generar variabilidad genética y fenotípica de forma impredecible, ofrecen ventajas inciertas y aleatorias a nivel individual, pero a nivel poblacional, sus beneficios se vuelven más evidentes. Esto plantea una pregunta fundamental sobre cómo estos mecanismos se seleccionan y se estabilizan evolutivamente.
Para explicar la selección de DG, se pueden aplicar dos teorías de selección: la selección por parentesco (fitness inclusiva) y la teoría de selección multinivel. La primera teoría, formulada por William D. Hamilton, sugiere que los organismos con genes compartidos tienen un incentivo evolutivo para ayudarse entre sí. En poblaciones de bacterias o patógenos estrechamente relacionados, los DG pueden seleccionarse bajo este marco de selección inclusiva. Sin embargo, en organismos multicelulares, donde los individuos suelen ser genéticamente distintos, la selección multinivel es más adecuada. Esta teoría postula que la selección natural actúa a diferentes niveles de organización biológica (células, individuos, grupos, especies), permitiendo que procesos desfavorables a un nivel puedan ser seleccionados si confieren beneficios a niveles superiores.
En las últimas décadas, la investigación en microbiología ha mostrado que los procesos de cooperación son comunes no solo entre organismos relacionados, sino también entre distintas especies y, en el caso de biofilms bacterianos, entre diferentes tipos de microorganismos. Esta cooperación ha dado lugar al concepto de holobionte, en el que un organismo, como el ser humano, es visto como una combinación de su propio genoma y el de su microbiota. Según esta perspectiva, la selección de DG en bacterias o en comunidades simbióticas podría entenderse como una selección a nivel del holobionte.
En conclusión, la selección de DG representa un desafío para las teorías evolutivas clásicas sobre cooperación. Dado que muchos DG son sistemas complejos y multitarea, es improbable que todos hayan sido seleccionados de la misma manera o basados en una única propiedad. En lugar de optar por una teoría explicativa específica, se busca formalizar y definir el mecanismo de los DG como una herramienta fundamental para entender la generación de diversidad y la adaptabilidad de los sistemas biológicos.
4.2.2.11.10.8 El rol e los generadores de diversidad en la evolución y biodiversidad
La teoría de la evolución no debería ser rígida; debe adaptarse conforme crece nuestro conocimiento. Desde la “síntesis moderna” o neodarwinismo, se ha ampliado esta teoría para incluir conceptos como la selección a múltiples niveles, la herencia extragenética y la construcción de nichos, entre otros. Hoy en día, es necesario integrar nuevos conocimientos sobre los mecanismos que generan diversidad genética y fenotípica. Diversos estudios han resaltado la importancia de la diversidad genética inducida por el estrés en organismos unicelulares, y aquí se propone el concepto de “Generadores de Diversidad” (DG) como mecanismos que producen variabilidad en la composición y el comportamiento de los sistemas biológicos, introduciendo respuestas impredecibles a las presiones ambientales.
Los DGs desafían el paradigma neodarwiniano clásico, que ve la diversidad como algo generado pasivamente y debido a eventos accidentales, proponiendo en cambio que los seres vivos pueden generar diversidad de forma activa como respuesta al estrés (dinámica “Reina Roja”) o de forma anticipativa (dinámica “Reina Blanca”). En organismos multicelulares con características de tipo K (ciclo de vida largo y menor tamaño poblacional), los DGs anticipativos pueden haber sido seleccionados para compensar la baja variabilidad genética derivada de mutaciones aleatorias.
Además de su papel en la evolución, los DGs son clave en la relación entre huésped y patógeno. Ambos cuentan con DGs que afectan sus interacciones y determinan en parte sus estrategias de adaptación. La individualización de la respuesta inmune puede ayudar a controlar epidemias, lo cual plantea la posibilidad de aplicar diferentes vacunas en una misma población para evitar una respuesta inmune homogénea y facilitar la diversidad inmunitaria.
Los DGs también impulsan la diversificación y especiación de dos maneras: generando nuevos alelos a través de mecanismos como la transferencia horizontal de genes (THG) y la meiosis, o promoviendo la robustez genética que ayuda a preservar alelos raros en la población. Ver la generación de diversidad como resultado de la acción de los DGs nos lleva a concluir que la biodiversidad no debe verse solo como una característica de la vida, sino como algo indispensable para su supervivencia, activamente generado por los propios sistemas biológicos. En este sentido, la falta de biodiversidad en muchos ecosistemas actuales debería alarmarnos, ya que nuestra supervivencia depende de la robustez de estos ecosistemas. Desde un punto de vista teórico, la diversidad, la autoorganización y la imprevisibilidad se consideran características fundamentales de los sistemas biológicos. Reconocer la existencia de DGs regulados permite entender cómo los sistemas biológicos pueden diversificarse y mostrar patrones tanto ordenados como impredecibles.
4.2.2.11.10.9 Predicciones teóricas
Esta propuesta, a diferencia del paradigma evolucionista clásico, que ve la diversidad exclusivamente como resultado de procesos accidentales, que una gran parte de la diversidad genética y fenotípica es consecuencia de mecanismos regulados, a los que se le da el nombre de Generadores de Diversidad. De esta se derivan dos predicciones, refutables experimentalmente, sobre los generadores de diversidad:
Indispensabilidad de los DGs para la supervivencia: Los DGs son esenciales para la supervivencia de los organismos vivos. Así, todos los organismos biológicos naturales deben poseer al menos un mecanismo que cumpla con la definición de un DG. Por ejemplo, los mecanismos de Transferencia Horizontal de Genes (THG) se han descrito en todas las bacterias y arqueas, y la mayoría de los eucariotas muestran reproducción meiótica/sexual. Los metazoos raros, como los rotíferos, que han perdido la meiosis sexual pero siguen siendo diversos, parecen tener altos niveles de THG, lo cual podría compensar la falta de recombinación genética sexual.
Dependencia de la dinámica de los DGs de la presión selectiva y de la estrategia r/K: La dinámica de los DGs varía según la intensidad de las presiones selectivas ambientales y la estrategia de reproducción de los organismos (r/K). Esta predicción parece estar respaldada por (i) la adquisición de DGs especializados por patógenos expuestos constantemente a la respuesta inmune adaptativa del huésped y (ii) la adquisición de DGs anticipativos por organismos multicelulares complejos para compensar sus características K, como un ciclo reproductivo largo y poblaciones pequeñas.
Lectura recomendada
Muraille, E. (2018). Diversity generator mechanisms are essential components of biological systems: The two queen hypothesis. Frontiers in microbiology, 9, 223.