2 Diversificación global y extinción
2.1 Conceptos básicos
El interés en la diversidad biológica y su evolución a lo largo del tiempo se disparó en el último cuarto del siglo XX, impulsado por los avances tecnológicos y la creciente preocupación por la crisis de biodiversidad actual. El registro fósil ha sido una pieza clave para comprender cómo las especies han surgido, diversificado y desaparecido, mientras que la llegada de las computadoras ha permitido a los paleobiólogos analizar grandes conjuntos de datos y aplicar métodos estadísticos avanzados. En este contexto, la investigación se ha orientado no solo a quantificar el número de especies (riqueza taxonómica), sino también a entender la diversidad de formas (disparidad) y roles ecológicos o funciones (diversidad funcional) que esos grupos han adoptado y cómo estas varían en el tiempo y el espacio.
Cada una de estas métricas captura distintos aspectos de la diversidad. Por ejemplo, la riqueza taxonómica es una medida directa del número de especies, mientras que la disparidad y la diversidad funcional pueden reflejar la capacidad de un grupo para ocupar diferentes nichos ecológicos. Uno de los debates centrales en macroevolución es si la riqueza taxonómica, la disparidad y la diversidad funcional siguen patrones temporales similares o si responden a eventos de manera independiente. A nivel global, estudios recientes han puesto a prueba la tendencia macroevolutiva que sostiene que muchos clados alcanzan su máxima disparidad relativamente temprano en su historia evolutiva, un fenómeno conocido como alta disparidad temprana.
La mayoría de los clados de metazoos que se diversificaron durante el Fanerozoico alcanzaron su mayor variedad de formas (o “disparidad”) en las primeras etapas de sus historias evolutivas. Este patrón, conocido como “alta disparidad temprana,” implica que la explosión de formas morfológicas y ecológicas tiende a ocurrir al inicio de un clado, antes de que las líneas evolutivas se estabilicen. Sin embargo, este mismo patrón no se observa en clados cuyas historias evolutivas fueron interrumpidas por eventos de extinción masiva, que abruptamente acortaron sus trayectorias (Fig. 2.1).
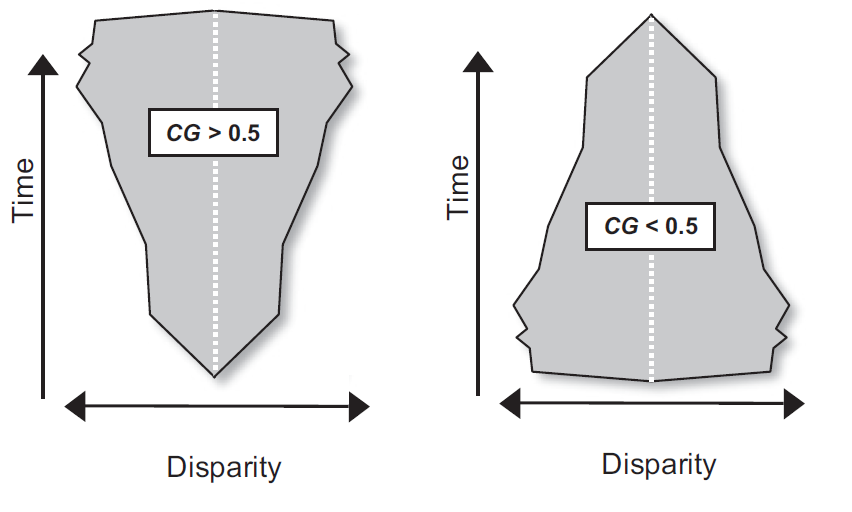
Figura 2.1: Representaciones de perfiles de disparidad de un clado a lo largo del tiempo, mostrando un ejemplo de disparidad máxima final en el panel izquierdo y de disparidad máxima inicial en el panel derecho. Imagen modificada de Hughes et al. (2013).
Para explicar esta tendencia de alta disparidad temprana, se proponen dos hipótesis no mutuamente excluyentes:
Oportunidad ecológica y radiación adaptativa temprana: Al inicio de una línea evolutiva, es posible que existan espacios ecológicos vacíos o menos competidos. Esto ofrece un marco ideal para que los primeros representantes de un clado exploren una amplia gama de nichos y adopten diversas formas y funciones sin limitaciones competitivas fuertes.
Aumento de las restricciones de desarrollo: A medida que las especies se diversifican y evolucionan, sus sistemas de desarrollo y redes genéticas se vuelven más complejas y entrelazadas. Esto conduce a una mayor integración entre las partes anatómicas y un nivel más alto de interdependencia en los sistemas regulatorios genéticos, limitando el rango de variación posible en etapas posteriores.
Este patrón macroevolutivo parece claro a nivel de filo y clase, donde muchos grupos alcanzan su diversidad de formas al inicio y luego experimentan un período de menor cambio. Sin embargo, esta tendencia no parece aplicarse de manera universal a nivel de reino, lo que sugiere que diferentes factores o mecanismos macroevolutivos pueden estar en juego en escalas taxonómicas más amplias.
Además de la variación temporal, el estudio de la diversidad revela también diferencias espaciales, como el notable gradiente latitudinal. Este gradiente muestra una disminución en la diversidad taxonómica desde las regiones tropicales hacia los polos, lo cual es evidente en muchos grupos de organismos. Conforme se avanza hacia los polos, la cantidad de especies disminuye, y lo mismo sucede con el número de grupos funcionales o tipos ecológicos. Sin embargo, este cambio va acompañado de un aumento en la equidad funcional, es decir, una distribución más equilibrada de especies entre los diferentes roles funcionales. Esto sugiere que, aunque la diversidad de especies desciende en los polos, los grupos que permanecen son capaces de ocupar los nichos ecológicos de forma más balanceada. Este equilibrio en la representación de funciones en regiones de baja diversidad taxonómica apunta a una resiliencia funcional, donde las especies restantes logran mantener una diversidad funcional elevada, adaptándose a los espacios ecológicos con una proporción más uniforme de tipos funcionales.
La comparación entre riqueza taxonómica, disparidad morfológica y diversidad funcional revela que estos aspectos de la biodiversidad no siempre coinciden y responden de maneras diferentes a las presiones evolutivas y ambientales. Mientras que muchos clados muestran una “alta disparidad temprana” al diversificarse, lo que refleja un gran rango de formas iniciales que luego se estabiliza, la diversidad funcional parece ser más estable a lo largo del tiempo, incluso frente a eventos de extinción masiva. Esto sugiere que los roles ecológicos esenciales tienden a persistir, lo que hace a la diversidad funcional más resiliente que la taxonómica. Estos patrones nos brindan una perspectiva crucial sobre el impacto potencial de la actual crisis de biodiversidad, ayudándonos a anticipar los efectos en la funcionalidad de los ecosistemas, más allá de la simple pérdida de especies.
Lectura recomendada
Clark, J. W., Hetherington, A. J., Morris, J. L., Pressel, S., Duckett, J. G., Puttick, M. N., … & Donoghue, P. C. (2023). Evolution of phenotypic disparity in the plant kingdom. Nature Plants, 9(10), 1618-1626.
Deline, B., Greenwood, J. M., Clark, J. W., Puttick, M. N., Peterson, K. J., & Donoghue, P. C. (2018). Evolution of metazoan morphological disparity. Proceedings of the National Academy of Sciences, 115(38), E8909-E8918.
Edie, S. M., Jablonski, D., & Valentine, J. W. (2018). Contrasting responses of functional diversity to major losses in taxonomic diversity. Proceedings of the National Academy of Sciences, 115(4), 732-737.
Hughes, M., Gerber, S., & Wills, M. A. (2013). Clades reach highest morphological disparity early in their evolution. Proceedings of the National Academy of Sciences, 110(34), 13875-13879.
Smith, T. J., & Donoghue, P. C. (2022). Evolution of fungal phenotypic disparity. Nature Ecology & Evolution, 6(10), 1489-1500.
2.2 Evolucion temporal de los conceptos de diversificación y extinción
El estudio de la diversidad de la vida en la Tierra y su inevitable desaparición ha sido uno de los temas centrales en la paleontología desde sus comienzos. Los conceptos de diversificación y extinción han evolucionado en paralelo a los descubrimientos paleontológicos y a las teorías geológicas, marcando diferentes perspectivas y metodologías para entender la historia de la vida. Desde los primeros trabajos de Georges Cuvier en el siglo XIX hasta los análisis meticulosos de Jack Sepkoski en el siglo XX, la extinción y la diversificación se han abordado desde enfoques catastróficos, gradualistas y evolutivos, cada uno influyendo en cómo comprendemos la dinámica de la biodiversidad a lo largo del tiempo.
Lectura recomendada
Taylor, P. D. (Ed.). (2004). Extinctions in the History of Life. Cambridge University Press.
2.2.0.1 Georges Cuvier y la realidad de las extinciones antiguas
Como ya hemos visto anteriormente (Sección 1.1.15.1), Georges Cuvier (1769-1832) fue uno de los primeros científicos en reconocer la realidad de las extinciones antiguas. Sus estudios sobre los fósiles de los depósitos cenozoicos en París y sus alrededores revelaron que muchas de las especies de grandes mamíferos (‘cuadrúpedos’) que existieron en el pasado ya no tenían representantes vivos. En 1812, Cuvier argumentaba que dado que la mayoría de las especies grandes de cuadrúpedos eran conocidas, los fósiles que no coincidían con ninguna de ellas pertenecían a especies ya extintas. Este enfoque permitía una validación precisa de la extinción, usando comparaciones anatómicas detalladas.
Para explicar la desaparición de estas especies, Cuvier propuso la teoría del catastrofismo, sugiriendo que grandes trastornos geológicos, distintos de los procesos observados en tiempos modernos, eran responsables de las extinciones. En este contexto, Cuvier no consideraba plausible que las especies, altamente adaptadas a sus entornos, pudieran extinguirse de forma gradual, lo que reforzaba su visión de extinciones súbitas y dramáticas en eventos catastróficos .
2.2.0.2 Alcide d’Orbigny y la expansión del catastrofismo
Alcide d’Orbigny (1802-1857) (Fig. 2.2), alumno de Cuvier, amplió las ideas de su mentor, argumentando que la vida en la Tierra había pasado por 27 extinciones catastróficas, cada una seguida de la creación de una nueva biota. De acuerdo con d’Orbigny, todas las especies vivientes eran exterminadas en cada evento de extinción y reemplazadas posteriormente por una biota totalmente nueva. Esto implicaba que la historia de la vida estaba marcada por una serie de renovaciones completas, una visión coherente con el catastrofismo. D’Orbigny también fue pionero en la clasificación de las etapas estratigráficas, como el Bajociano y el Cenomaniano, que aún se emplean, aunque de forma modificada, en la geología moderna para representar intervalos de tiempo específicos dominados por distintas biotas.

Figura 2.2: Retrato de Alcide d’Orbigny. Imagen disponible bajo licencia Creative Commons CC0.
2.2.0.3 Charles Darwin y la selección natural como mecanismo de extinción
En contraste con el catastrofismo de Cuvier y d’Orbigny, Charles Darwin (1809-1882) (Sección 1.1.17.1) introdujo una perspectiva evolucionista basada en el uniformismo, influenciado por Charles Lyell. Darwin defendía que las extinciones ocurrían de manera gradual y no eran el resultado de eventos súbitos. Según Darwin, la selección natural era un mecanismo suficiente para explicar la desaparición de especies. En “El origen de las especies” (1859), escribió que los descendientes mejorados de una especie generalmente causan el exterminio de sus predecesores, lo que reflejaba una visión en la que la extinción era un proceso natural en la competencia evolutiva.
2.2.0.4 John Phillips y las grandes transiciones en la diversidad de la vida
El geólogo británico John Phillips (1800-1874) fue uno de los primeros en intentar cuantificar los cambios en la diversidad de la vida desde el Cámbrico hasta la actualidad. Su diagrama de diversidad frente al tiempo en 1860 (Fig. 2.3) mostró dos caídas importantes en la biodiversidad al final del Paleozoico y del Mesozoico, eventos ahora identificados como las extinciones masivas del Pérmico y del Cretácico-Terciario (K-T). Phillips identificó patrones en las transiciones de vida que marcaron el fin de las eras geológicas, lo cual representaba un temprano reconocimiento de los ciclos de diversificación y extinción en la historia de la vida en la Tierra.
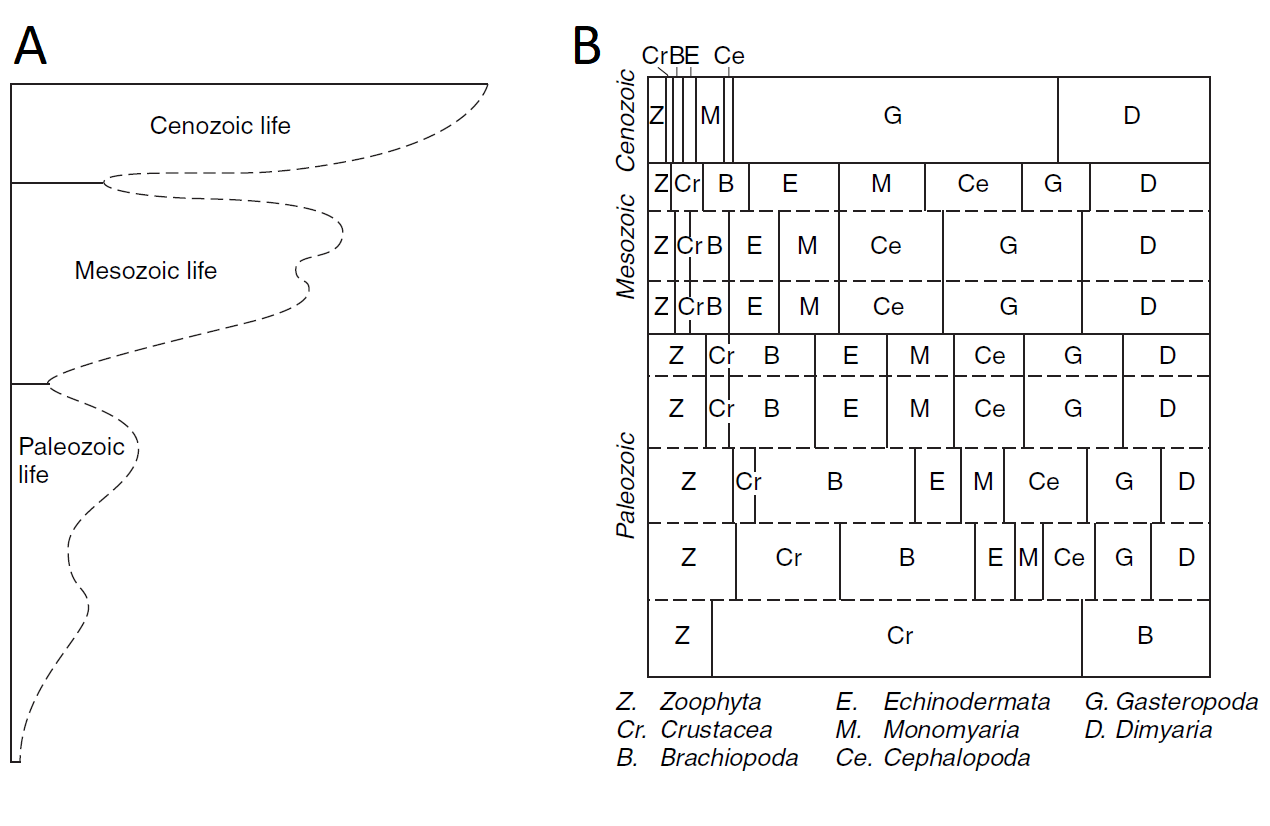
Figura 2.3: Representación de Phillips sobre la historia de la diversidad marina del Fanerozoico, basada en las ocurrencias de fósiles marinos en Gran Bretaña. (A) Una ilustración de los cambios a través del tiempo en el número de especies. (B) Un resumen de los cambios a través del tiempo en las contribuciones relativas de los principales taxa a la composición general de la biota marina. Aunque algunos de los nombres están desactualizados (por ejemplo, ‘Crustacea’ se refiere principalmente a los trilobites y ‘Dimyaria’ son moluscos bivalvos), las transiciones que Phillips representó se aproximan estrechamente a las ilustradas más de un siglo después por otros investigadores. Imagen tomada de Phillips (1860).
2.2.0.5 Jack Sepkoski, David Raup y los “Cinco Grandes” eventos de extinción masiva
El estudio de los patrones de extinción y diversificación experimentó un resurgimiento significativo en el último cuarto del siglo XX con el trabajo de Jack Sepkoski (1948-1999). A partir de una exhaustiva base de datos de rangos de familias y géneros marinos en el Fanerozoico, Sepkoski, en colaboración con David Raup, documentó los “Cinco Grandes” eventos de extinción masiva en un artículo de 1982. Además, sugirieron una posible periodicidad en los eventos de extinción cada 26 millones de años, lo que provocó una gran cantidad de estudios sobre posibles causas, incluidas hipótesis de fenómenos extraterrestres como impactos de meteoritos.
Sepkoski también descompuso el patrón de diversidad de la fauna marina en las “Tres Grandes Faunas Evolutivas” —la Cámbrica, la Paleozoica y la Moderna—, cada una caracterizada por tasas de origen y extinción específicas y marcadas por extinciones masivas. Este enfoque permitió una comprensión más matizada de cómo la biodiversidad y la composición de la vida en los océanos ha cambiado drásticamente a lo largo del tiempo.
Lectura recomendada
Foote, M. (2015). David M. Raup, 1933–2015. Proceedings of the National Academy of Sciences, 112(49), 15002-15003.
Raup, D. M., & Sepkoski Jr, J. J. (1982). Mass extinctions in the marine fossil record. Science, 215(4539), 1501-1503.
Sepkoski, J. J. (1984). A kinetic model of Phanerozoic taxonomic diversity. III. Post-Paleozoic families and mass extinctions. Paleobiology, 10(2), 246-267.
2.2.0.6 Hacia una comprensión integral de la diversificación y extinción
A medida que la investigación ha avanzado (Fig. 2.4), las extinciones masivas han sido entendidas como fenómenos complejos, no atribuibles a una sola causa común. La disminución de la tasa de extinción de fondo, combinada con los eventos de extinción masiva asociados a factores climáticos y ambientales, señala la interacción de múltiples factores en la pérdida de biodiversidad. Hoy, las teorías de diversificación y extinción se han diversificado con enfoques interdisciplinarios que consideran tanto el contexto ecológico como las implicaciones evolutivas, brindando una comprensión cada vez más integral de cómo se ha desarrollado y destruido la vida en la Tierra.
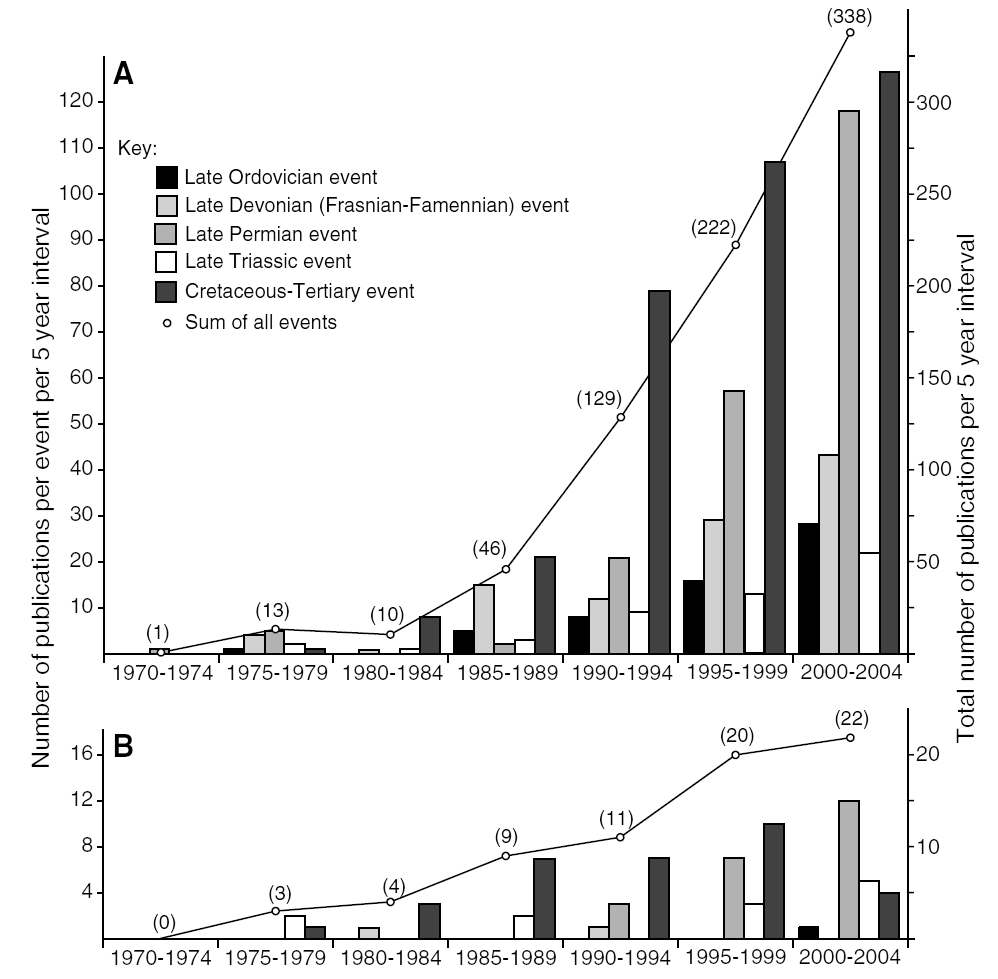
Figura 2.4: Interés científico en los eventos de extinción masiva desde 1970. Los datos provienen de un análisis de la base de datos ISI Web of Science y fueron recopilados a través del motor de búsqueda en línea de Web of Science. Para cada intervalo de 5 años, se realizó una búsqueda utilizando las palabras clave ‘extinción’ más ‘el período geológico en cuestión’ (es decir, ‘Ordovícico’, ‘Devoniano’, ‘Pérmico’, ‘Triásico’, ‘Cretácico’, respectivamente). Los resultados fueron revisados manualmente y se eliminaron los artículos que no pertenecían al evento en cuestión. (A) El conjunto de datos completo. (B) Solo las revistas Science y Nature. Imagen tomada de Twitchett (2006).
Lectura recomendada
Twitchett, R. J. (2006). The palaeoclimatology, palaeoecology and palaeoenvironmental analysis of mass extinction events. Palaeogeography, Palaeoclimatology, Palaeoecology, 232(2-4), 190-213.
2.3 Diversificación global
2.3.1 Métodos para la construcción de curvas de diversidad global
2.3.1.1 Diversidad bruta
La construcción de curvas de diversidad global permite estimar la cantidad de taxones en intervalos estratigráficos consecutivos, representados en gráficas x-y, con el objetivo de reflejar cambios en la diversidad a lo largo del tiempo geológico. Este método supone que cada taxón existió a lo largo de todo el intervalo entre su primera y última aparición en el registro fósil. Sin embargo, esta práctica enfrenta desafíos clave, incluyendo el efecto conocido como Pull of the Recent (Fig. 2.5), que introduce un sesgo hacia el presente debido al aumento de rocas expuestas y la mayor precisión en el muestreo de la diversidad actual en comparación con épocas geológicas anteriores. Este sesgo tiende a extender artificialmente los rangos de taxones del Mesozoico y Cenozoico hasta el presente.
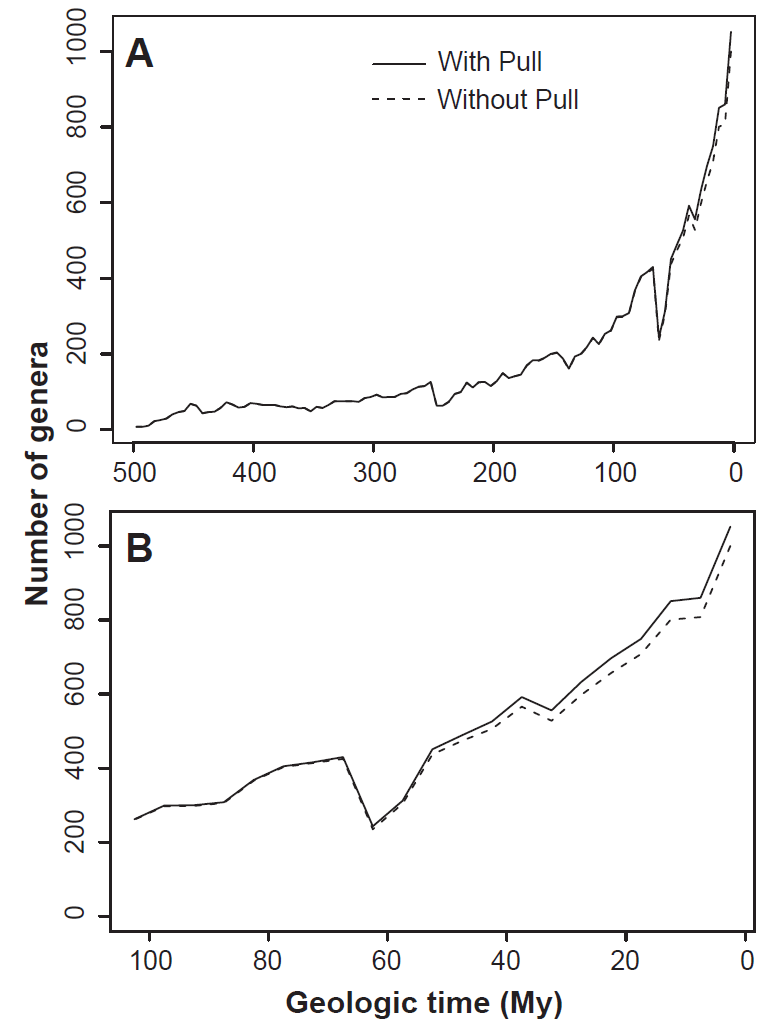
Figura 2.5: Riqueza a nivel de género de bivalvos marinos con y sin el Pull of the Recent (líneas sólidas y discontinuas, respectivamente). El intervalo de tiempo más reciente incluye 958 taxa actuales más 92 taxa extintas. (A) A través del Fanerozoico. (B) Durante los últimos 100 millones de años. Imagen tomada de Jablonski et al. (2003).
Para mejorar la precisión de estas curvas y mitigar sesgos, se suelen adoptar algunas estrategias:
- Eliminación de Singletons: Para reducir el efecto del “Pull of the Recent,” es común eliminar los taxones que aparecen solo en un intervalo (singletons), especialmente en períodos recientes que están bien muestreados (Fig. 2.6).
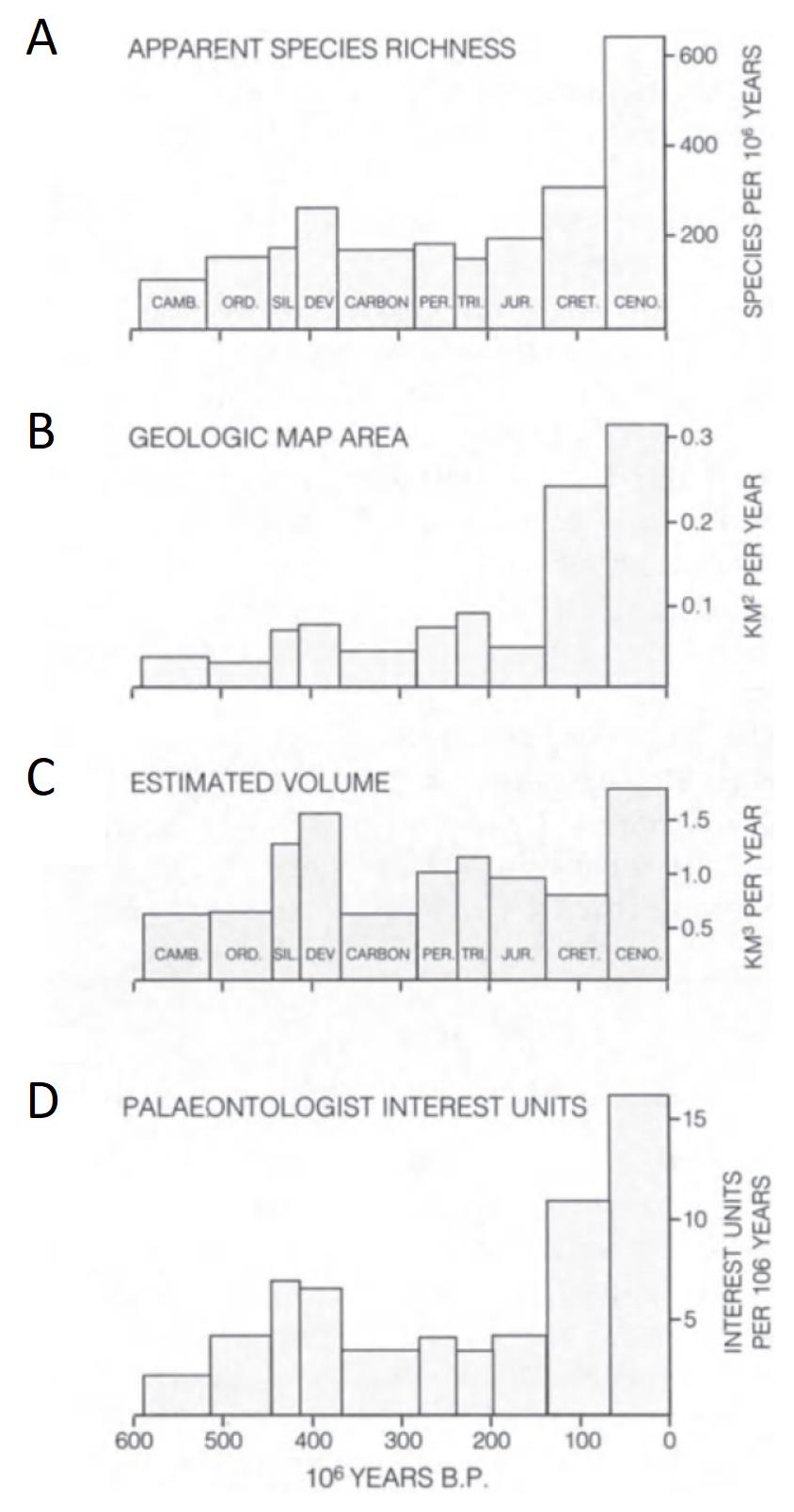
Figura 2.6: (A) Riqueza aparente de especies basada en el número de especies registradas en relación con el período de tiempo de cada sistema. (B) Área de afloramiento de cada sistema. (C) Volumen estimado de roca disponible para inspección. (D) Intensidad de estudio paleontológico de cada sistema, basada en los intereses declarados de los paleontólogos en el Directorio de Paleontólogos del Mundo. Imagen tomada de Brenchley & Harper (1997).
- Uso de Rangos Taxonómicos Más Amplios: Al analizar diversidad en niveles taxonómicos más altos, como géneros o familias, se suavizan las variaciones abruptas, ofreciendo una visión más estable de los patrones de diversidad (Fig. 2.7).
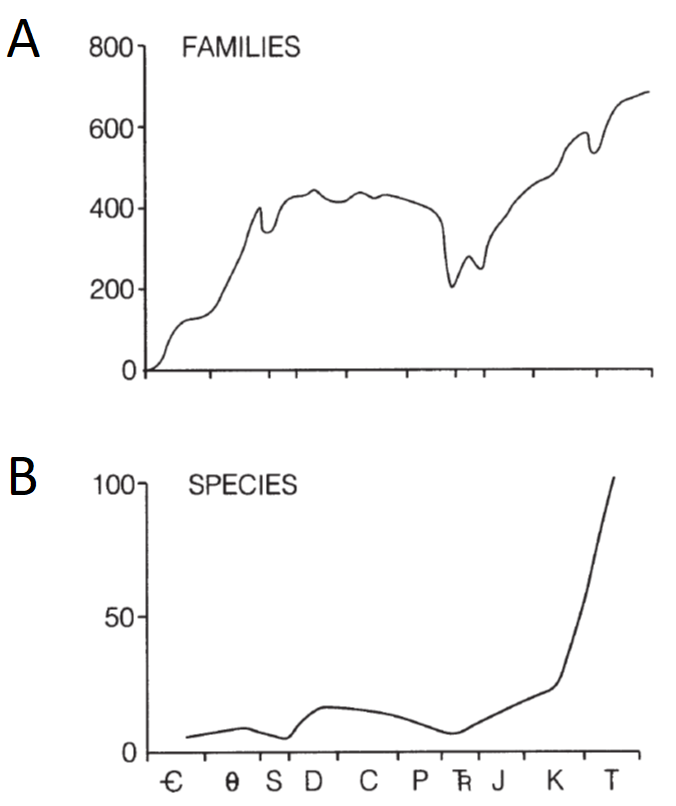
Figura 2.7: Comparativa entre curvas de diversidad del Fanerozoico capturadas considerando (A) familias y (B) especies. Imagen tomada de Brenchley & Harper (1997).
- Métodos de Taxones que Cruzan Límites (Boundary-Crossing): Este método considera únicamente los taxones que existen en intervalos consecutivos, ayudando a disminuir los efectos de muestreo y los problemas derivados de intervalos de tiempo irregulares, lo que permite una representación más coherente de la biodiversidad (Fig. 2.8).
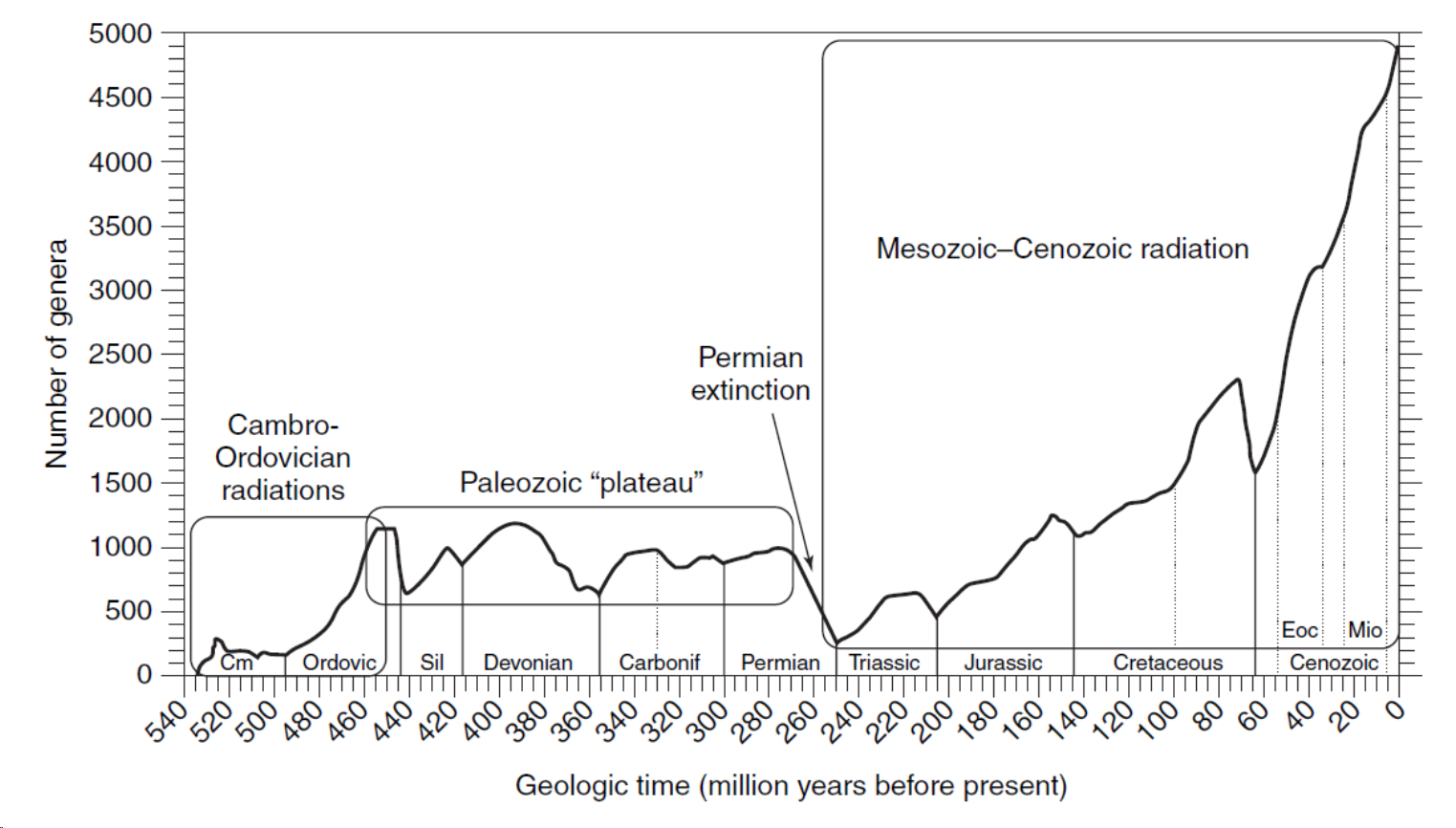
Figura 2.8: Comparativa entre curvas de diversidad del Fanerozoico capturadas considerando (A) familias y (B) especies. Imagen tomada de Foote & Miller (2007).
Lectura recomendada
Foote, M., Miller, A. I., Raup, D. M., & Stanley, S. M. (2007). Principles of paleontology. Freeman and Company.
Jablonski, D., Roy, K., Valentine, J. W., Price, R. M., & Anderson, P. S. (2003). The impact of the pull of the recent on the history of marine diversity. Science, 300(5622), 1133-1135.
2.3.1.2 Modelos de corrección de la diversidad bruta
Contar simplemente el número de taxones (por ejemplo, especies, géneros, familias) que aparecen en los fósiles de cada intervalo geológico sucesivo proporciona lo que se llama la “diversidad taxonómica bruta”, pero los científicos desde el principio han reconocido que estos datos altamente sesgados no deben ser aceptados sin cuestionamientos. Actualmente hay al menos cuatro métodos amplios para corregir los datos fósiles, que se discutirán a continuación: enfoques de muestreo, enfoques de residuos, enfoques filogenéticos y enfoques basados en modelos de nacimiento-muerte. Todos estos enfoques implican el uso de modelos de alguna manera.
Lectura recomendada
Bokulich, A. (2021). Using models to correct data: Paleodiversity and the fossil record. Synthese, 198(Suppl 24), 5919-5940.
2.3.1.2.1 Enfoques de muestreo
El primer enfoque para corregir los datos de paleodiversidad es la rarefacción o el muestreo. El objetivo de los métodos de muestreo es corregir los sesgos en los datos fósiles que surgen de las diferencias en el tamaño de la muestra. Aunque no es posible contar con una muestra completa o integral en paleontología, el objetivo es corregir los datos para que al menos sean una muestra “justa”. Sin embargo, ¿qué significa tener una muestra “justa”? En lo que ahora se conoce como el método de “rarefacción clásica” introducido en paleontología por Raup en 1975, se asumió que una muestra justa era una que era uniforme: que todas las muestras tenían aproximadamente el mismo número de individuos (ya sean ejemplares o, más a menudo en paleontología, “ocurrencias”, que es el número de taxones en una colección de ejemplares) (Sección 1.2.4). En una serie de artículos publicados en 2010, John Alroy argumenta que el método de rarefacción clásica no es, de hecho, adecuado para corregir estos sesgos de muestreo. Intuitivamente, la preocupación es que cuando la diversidad (o “riqueza”) es baja, no necesitas muestrear mucho para averiguar qué hay. Cuando la diversidad es alta, necesitas muestrear más para obtener una imagen precisa de lo que hay. Alroy propone entonces el método de rarefacción basada en cobertura siendo este una mejora significativa sobre la rarefacción clásica en la corrección de sesgos de muestreo, aunque, depende de la suposición idealizada de muestreo aleatorio, que no se sostiene en el caso de los datos fósiles reales.
2.3.1.2.2 Enfoques de residuos
El segundo enfoque para corregir sesgos en los datos fósiles es el método de residuos (Fig. 2.9). La idea central detrás de este método es ver la curva de diversidad taxonómica “bruta” de los datos fósiles como una combinación de señales biológicas y geológicas (así como antropogénicas y otras). Si uno puede modelar los efectos de la señal geológica sola, entonces podría “sustraerla” de la curva de diversidad bruta, dejando atrás la señal biológica predominantemente deseada. La señal geológica se entiende como “la cantidad de roca sedimentaria preservada en afloramientos”. “Roca sedimentaria” porque ese es el tipo de roca en el que se forman y preservan los fósiles, y “en afloramientos”, porque los procesos tectónicos y erosionales necesitan llevar la roca sedimentaria de ese período de tiempo a la superficie de la Tierra donde puede ser encontrada por los paleontólogos. El problema para construir curvas de datos de paleodiversidad a lo largo del tiempo es que la cantidad de roca sedimentaria disponible en afloramientos de diferentes períodos geológicos es altamente variable. El primer método de corrección en este sentido fue propuesto en el 2007 por Smith y McGowan e implica construir un modelo en el que el área de afloramiento de roca se toma como un predictor perfecto de la diversidad muestreada y luego se usa esto como un “modelo de sustracción” para obtener la señal biológica que hasta ahora estaba enmascarada. La intuición es que la parte “residual” restante de la señal de paleodiversidad, que no es explicada por el área de afloramiento de roca, puede atribuirse a la señal biológica. Esta primera aproxiamción inició toda una familia de enfoques de modelos residuales.
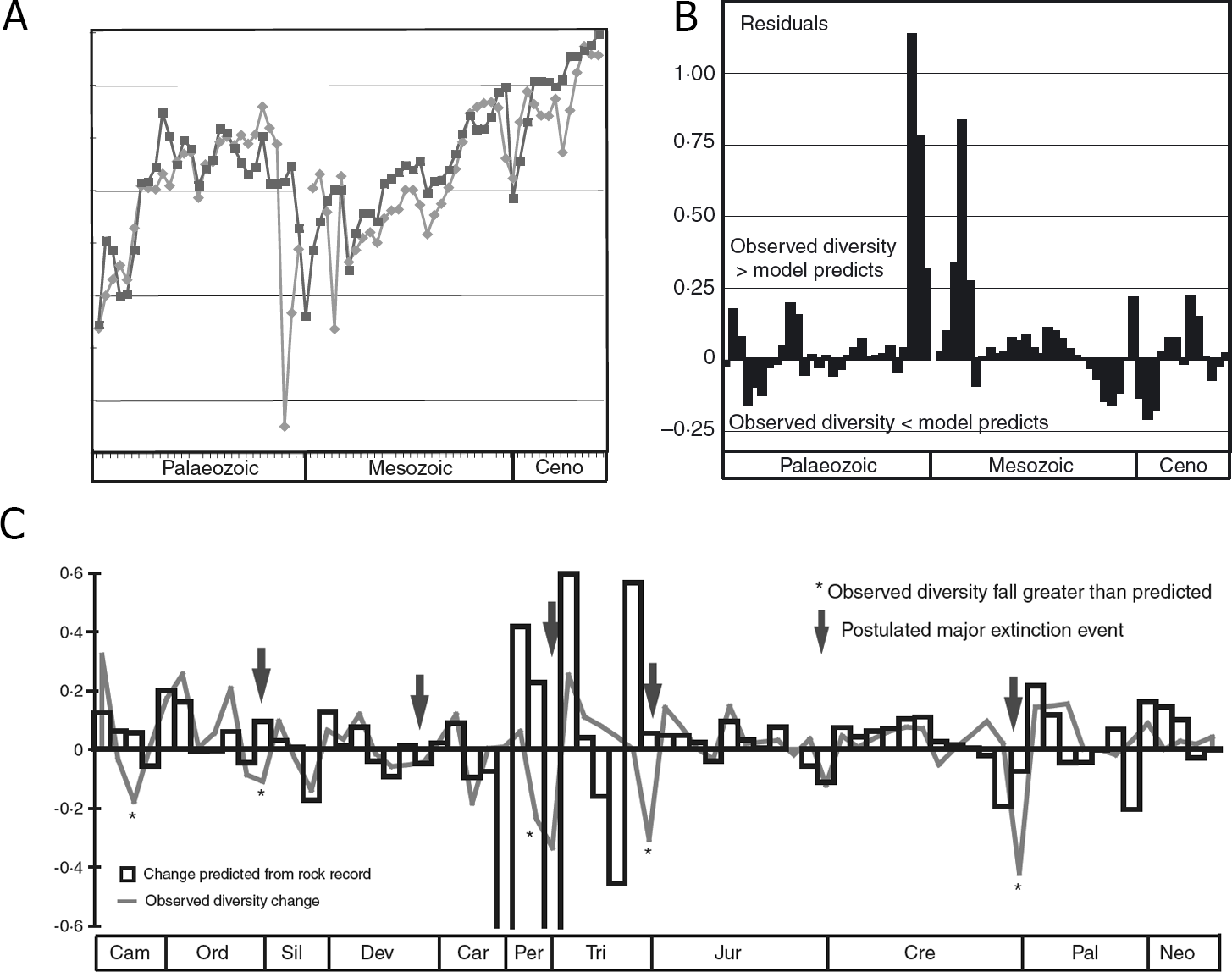
Figura 2.9: (A) Diversidad de géneros marinos muestreados del Fanerozoico (‘observada’, gris oscuro) comparada con la diversidad predicha (gris claro) en función del área de afloramiento de sedimentos marinos. (B) Residuales tras restar la curva del modelo de diversidad predicha de la curva de diversidad observada. (C) Gráfico de serie temporal de las primeras diferencias de la diversidad observada de géneros marinos y de la diversidad predicha derivada del área de afloramiento de rocas marinas. La correlación entre ambas curvas es significativa. Las cinco grandes extinciones masivas ampliamente aceptadas están marcadas con flechas. Los asteriscos indican los intervalos de tiempo donde la disminución en la diversidad observada es mayor de lo predicho según el registro de rocas. Imagen tomada de Smith & McGowan (2007).
Lectura recomendada
Smith, A. B., & McGowan, A. J. (2007). The shape of the Phanerozoic marine palaeodiversity curve: how much can be predicted from the sedimentary rock record of Western Europe?. Palaeontology, 50(4), 765-774.
2.3.1.2.3 Enfoques filogenéticos
El método del modelo filogenético se basa en reconstrucciones filogenéticas para inferir la presencia de linajes no preservados en el registro fósil, proporcionando una estimación corregida de la diversidad conocida como diversidad filogenética. En este enfoque se asume que los taxones hermanos divergieron simultáneamente de un ancestro común, de modo que si dos taxones, A y B, son hermanos y B aparece antes en el registro fósil, el ancestro común debió existir al menos en el tiempo de aparición de B. Dado que A no tiene registros fósiles entre el tiempo de aparición de B (_t_0) y su propia primera aparición (_t_2), se asume una “línea fantasma” de A durante ese intervalo, señalando que el linaje estaba presente aunque no se haya encontrado evidencia directa de fósiles. La diversidad filogenética incluye estas líneas fantasma, por lo que el conteo de diversidad en ese intervalo de tiempo refleja la coexistencia inferida de ambos taxones (A y B), a diferencia de la diversidad taxonómica bruta, que solo contaría a B en _t_0 y reflejaría un incremento en diversidad cuando A aparece en _t_2. Este enfoque permite una corrección que sugiere estabilidad en la diversidad de taxones durante intervalos con registros incompletos en lugar de incrementos espurios debido a ausencias en el registro fósil (Fig. 2.10).
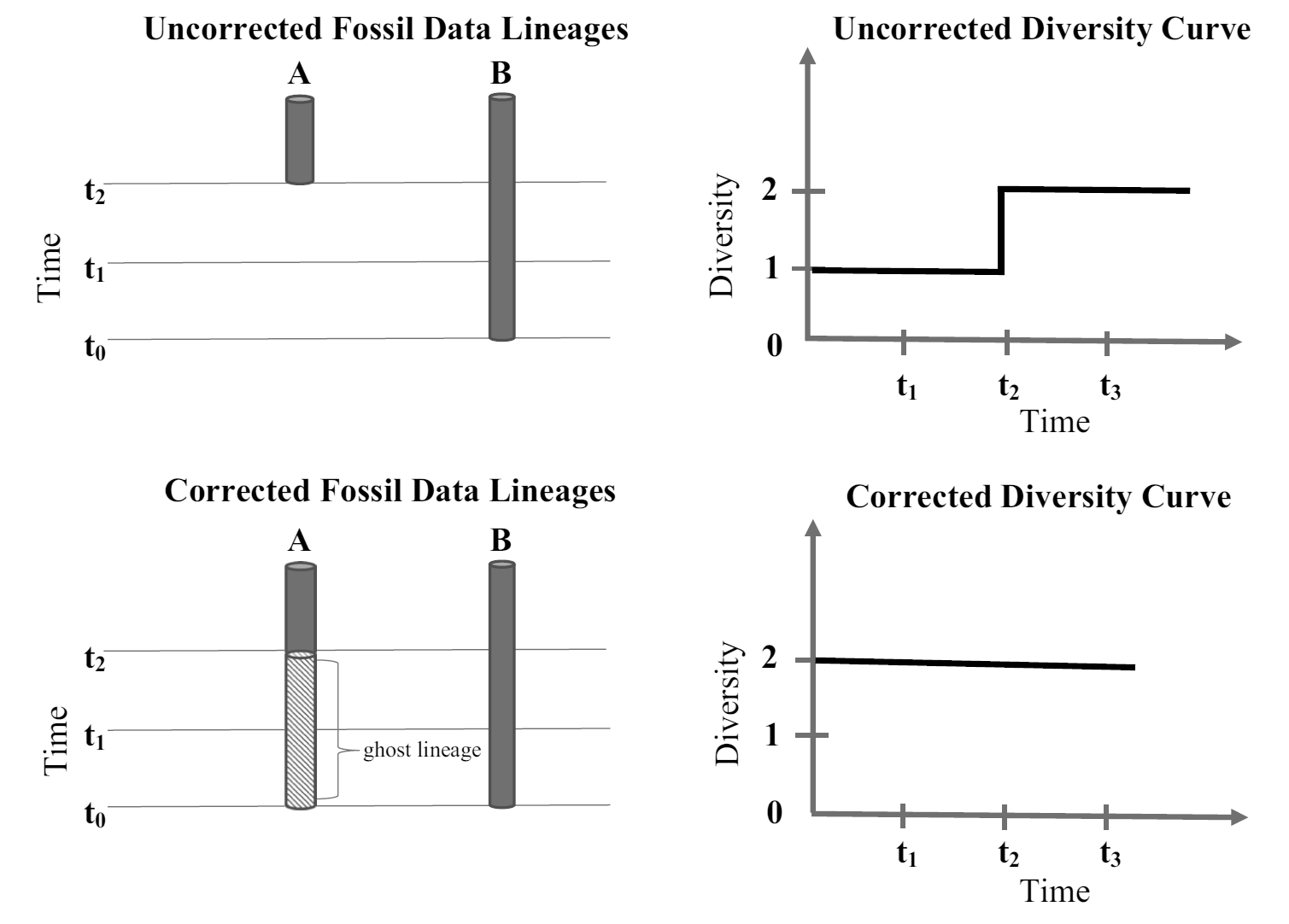
Figura 2.10: Datos corregidos mediante el modelo filogenético con la inclusión de la línea fantasma para el taxón A. Obsérvese la diferencia entre las curvas de paleodiversidad corregida y no corregida. Imagen tomada de Bokulich (2021).
Una segunda forma en que los métodos filogenéticos corrigen los datos fósiles es considerando lo que se conoce como taxones ‘Lázaro’. Un taxón Lázaro es un taxón que desaparece del registro fósil durante un largo período de tiempo, sugiriendo que se ha extinguido, pero luego un representante aparece nuevamente millones de años después o incluso como un espécimen vivo en el presente. Un famoso ejemplo de un taxón Lázaro de este tipo es el celacanto. Aunque los celacantos tienen un largo registro fósil desde el Devónico hasta el Cretácico, no aparecen en el registro fósil después del Cretácico y se pensaba que estaban extintos hasta que se capturó un espécimen vivo frente a la costa de Sudáfrica. Dada nuestra comprensión teórica de la evolución, debe haber una línea evolutiva continua que conecte la población del Cretácico con la población actual, y por lo tanto se añade una línea fantasma a los conteos de taxones en los 80 millones de años intermedios, incluso aunque no aparezcan fósiles de celacantos en ese intervalo estratigráfico.
Aunque los estudios de simulación parecen mostrar claramente que los datos corregidos por modelos utilizando cualquiera de estos métodos de corrección generalmente superan a los datos de diversidad taxonómica en bruto al proporcionar una mejor representación de la paleodiversidad, no está claro que puedan demostrar que uno de estos métodos de corrección de datos sea siempre mejor que los otros. Qué método es más fiable en un contexto dado probablemente dependerá de qué tipos de organismos se estén observando.
Lectura recomendada
Norell, M. A. (1993). Tree-based approaches to understanding history; comments on ranks, rules and the quality of the fossil record. American Journal of Science, 293(A), 407-417.
2.3.1.3 Enfoques basados en modelos de nacimiento-muerte: mcmcDivE
mcmcDivE es un método probabilístico que permite corregir las estimaciones de diversidad fósil teniendo en cuenta la preservación desigual del registro. A diferencia de los métodos tradicionales, que pueden verse sesgados por la variabilidad en la preservación, recolección y descripción de fósiles, mcmcDivE ajusta la diversidad observada para inferir una “verdadera” diversidad a lo largo del tiempo. Este ajuste se basa en las tasas de preservación calculadas por PyRate, un software basado en lenguaje Python que usa modelos de nacimiento-muerte dentro de un marco bayesiano para estimar tasas de especiación, extinción y preservación en distintos períodos. PyRate, al modelar estos procesos, permite inferir la probabilidad de que los fósiles de ciertos grupos se hayan conservado o no en diferentes intervalos de tiempo. Para cada intervalo, mcmcDivE modela la diversidad observada como una parte del total real, considerando tanto los taxones encontrados como los que, aunque estaban presentes, no aparecen en el registro fósil. La probabilidad de muestreo de fósiles se deriva de las tasas de preservación.
Lectura recomendada
Flannery-Sutherland, J. T., Silvestro, D., & Benton, M. J. (2022). Global diversity dynamics in the fossil record are regionally heterogeneous. Nature Communications, 13(1), 2751.
Silvestro, D., Schnitzler, J., Liow, L. H., Antonelli, A., & Salamin, N. (2014). Bayesian estimation of speciation and extinction from incomplete fossil occurrence data. Systematic biology, 63(3), 349-367.
2.3.2 Las faunas evolutivas y el modelo logístico acoplado
El desarrollo del modelo logístico acoplado ha sido fundamental para entender la dinámica de la diversificación de los taxones marinos a lo largo del Fanerozoico. En 1981, el paleontólogo David Sepkoski propuso una descripción cuantitativa de las transiciones entre los taxones marinos a lo largo de este vasto periodo. Sepkoski acuñó el término faunas evolutivas para describir amplios conjuntos de taxones que fueron dominantes a nivel global durante intervalos geológicos prolongados. Identificó tres faunas evolutivas durante el Fanerozoico. La fauna Cámbrica dominó los entornos marinos durante el Cámbrico, después de la explosión de diversidad al inicio del Fanerozoico, conocida como la Explosión Cámbrica. La fauna Paleozoica se diversificó significativamente durante la Radiación Ordovícica, cuando la diversidad global alcanzó niveles sin precedentes que se mantuvieron a lo largo de gran parte del resto del Paleozoico. La fauna Moderna, por su parte, tuvo una diversidad limitada durante la era Paleozoica, pero se diversificó notablemente después de esta era, convirtiéndose en la biota dominante de las eras Mesozoica y Cenozoica. Sepkoski argumentó que estas tres faunas evolutivas eran más que simples agrupaciones fortuitas de taxones. Las veía como unidades funcionales que interactuaban entre sí, provocando las grandes transiciones bióticas globales observadas a lo largo del Fanerozoico. Esta perspectiva ha sido cuestionada por muchos paleontólogos, en parte porque ahora se comprende que las faunas evolutivas no eran tan cohesivas internamente ni tan distintas entre sí en el espacio y el tiempo como Sepkoski lo había planteado en un principio. A pesar de ello, la perspectiva cuantitativa que propuso Sepkoski tuvo un impacto significativo en el desarrollo de la investigación a larga escala sobre las transiciones evolutivas.
El objetivo principal de Sepkoski era desarrollar un modelo matemático que describiera las características fundamentales de la diversificación marina a lo largo del Fanerozoico. En el corazón de este modelo se encuentra la ecuación logística, que se representa mediante una curva sigmoidal. Esta curva se caracteriza por un aumento exponencial inicial, seguido de una desaceleración en la tasa de crecimiento hasta alcanzar un equilibrio, y está inspirada en conceptos ecológicos relacionados con el crecimiento poblacional y la capacidad de carga.
El uso del modelo logístico acoplado se puede explicar en tres pasos:
- Momento inicial de crecimiento exponencial:
\[
d_t = d_{t-1} + r \cdot d_{t-1}
\]
Donde:
- dt es la diversidad en el momento t.
- dt-1 es la diversidad en el momento t-1.
- r es la tasa constante de incremento.
- Diversificación logística simple:
\[
r = k_s - k_e
\]
\[
d_t = d_{t-1} + (k_s - k_e) \cdot d_{t-1}
\]
Donde:
- ks es la tasa de especiación.
- ke es la tasa de extinción.
- Si ks > ke, la diversidad aumenta.
- Si ks < ke, la diversidad disminuye.
- Si ks = ke, la diversidad se mantiene estable.
- kst y ket son las tasas de especiación y extinción en el momento t.
- ks0 y ke0 son las tasas iniciales de especiación y extinción.
- a y b son constantes que determinan cuánto disminuye la tasa de originación y cuánto aumenta la tasa de extinción con la diversidad.
Si bien Sepkoski sugirió en 1978 que un modelo logístico podría describir adecuadamente los patrones de diversidad de órdenes marinos a lo largo del Fanerozoico, este no lograba explicar completamente los patrones observados en familias y géneros (Fig. 2.11).
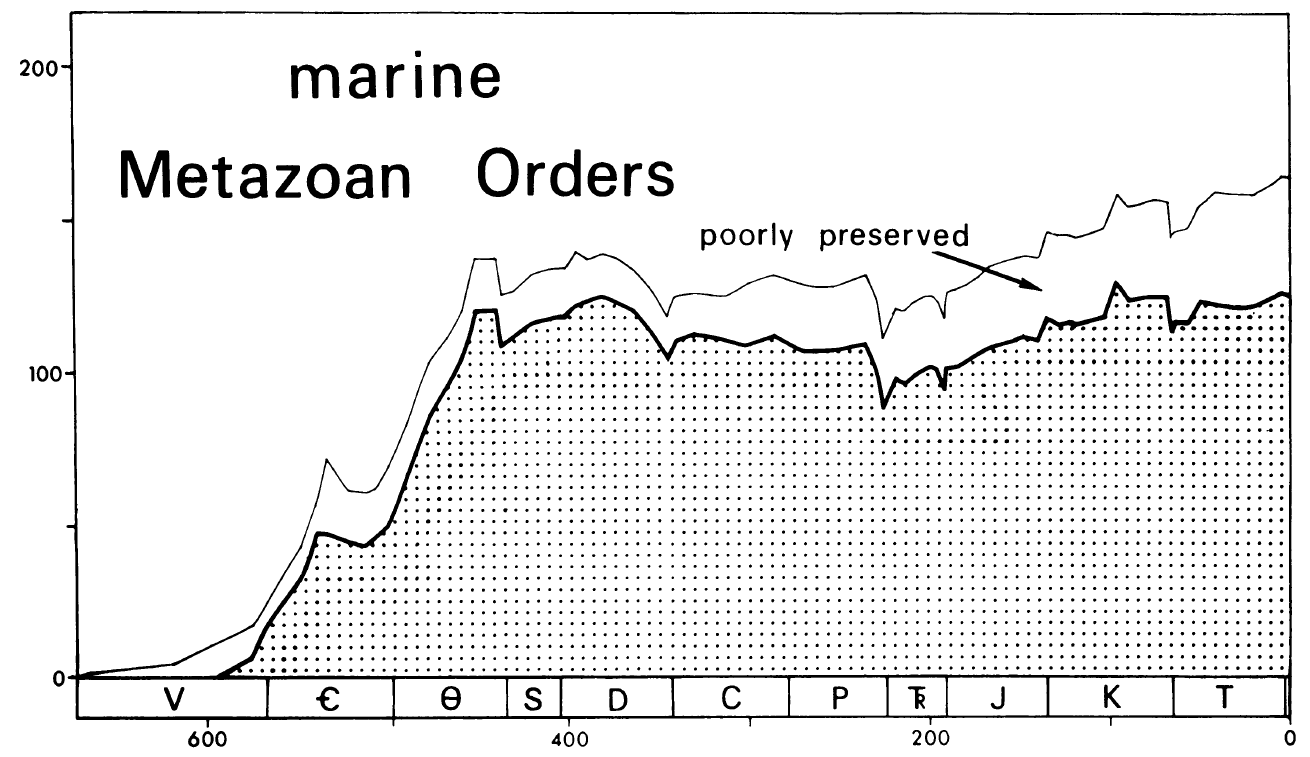
Figura 2.11: Registro completo del Fenerozoico de la diversidad de órdenes de metazoos marinos. Este gráfico ilustra la consistencia básica de este patrón de diversidad con el de un modelo logístico. Imagen tomada de Sepkoski (1978)
- Diversificación logística acoplada: El modelo logístico acoplado implica diversificaciones simultáneas de dos o más grupos, donde ks y ke dependen de la diversidad total. Este enfoque sugiere que la diversidad de un grupo puede afectar a la de otros grupos. Cada grupo se denomina como una “fase” distinta. Para un grupo o fase x, la ecuación se expresa como: \[ d_{x,t} = d_{x,t-1} + \left[(k_{s_0} - a \cdot DTOT_{t-1}) - (k_{e_0} + b \cdot DTOT_{t-1})\right] \cdot d_{x,t-1} \] Donde DTOTt-1_ representa la diversidad total de todas las fases en el momento t-1. Aunque los parámetros como ks0, ke0, a y b son constantes, pueden variar entre las diferentes fases del modelo.
Sepkoski, en sus trabajos de 1979 y 1984, concluyó que un modelo logístico acoplado describía adecuadamente los patrones de diversidad de familias y géneros observados desde el Paleozoico (Fig. 2.12A), especialmente cuando se simulaban eventos de extinción significativos (Fig. 2.12B).
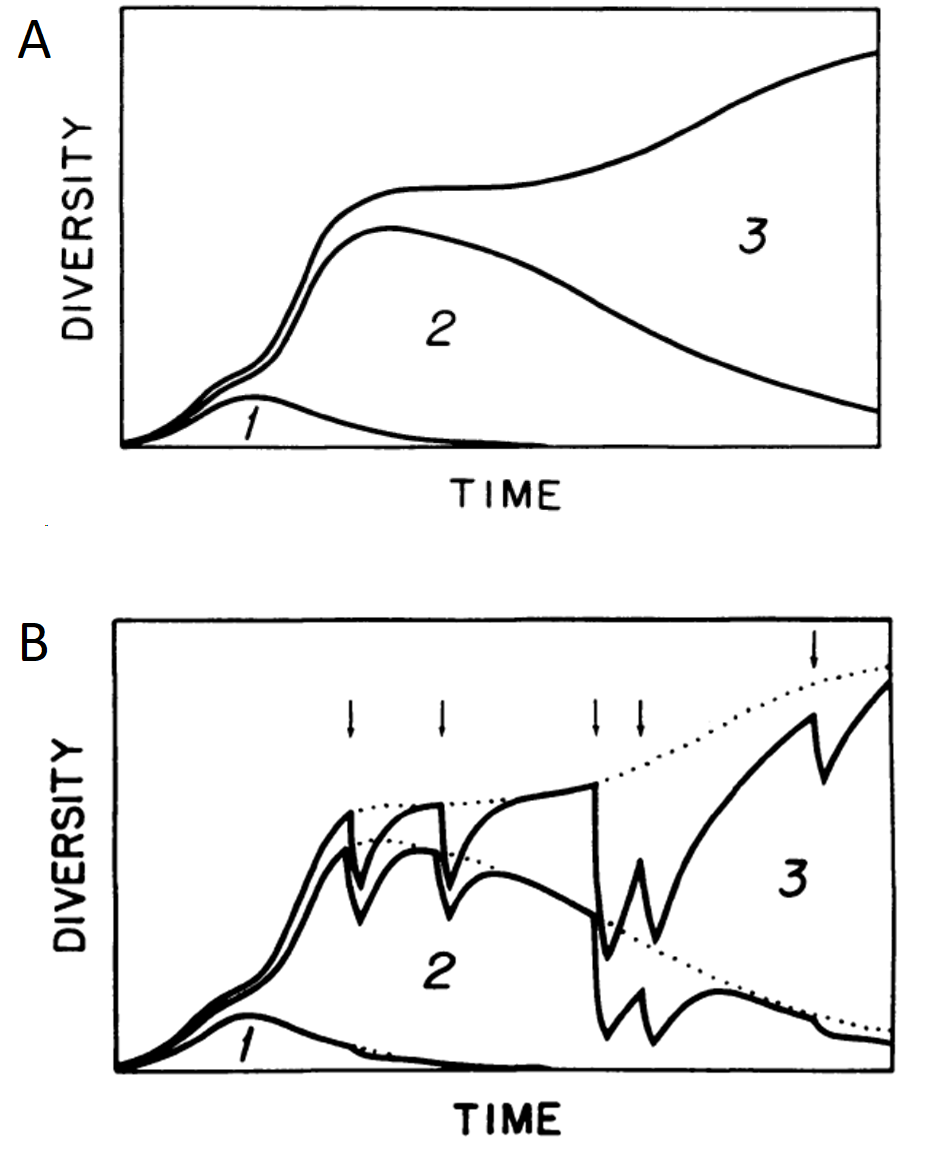
Figura 2.12: (A) Una solución numérica del modelo logístico acoplado ajustada a la diversidad de familias de metazoos marinos. (B) Esta solución con perturbaciones específicas del tiempo (indicadas por flechas) que simulan las principales extinciones masivas del registro fósil marino del Fenerozoico. La línea de puntos representa la trayectoria del sistema de tres fases sin perturbaciones. Imagen tomada de Sepkoski (1984)
Lectura recomendada
Sepkoski, J. J. (1978). A kinetic model of Phanerozoic taxonomic diversity I. Analysis of marine orders. Paleobiology, 4(3), 223-251.
Sepkoski, J. J. (1979). A kinetic model of Phanerozoic taxonomic diversity II. Early Phanerozoic families and multiple equilibria. Paleobiology, 5(3), 222-251.
Sepkoski, J. J. (1984). A kinetic model of Phanerozoic taxonomic diversity. III. Post-Paleozoic families and mass extinctions. Paleobiology, 10(2), 246-267.
2.3.3 Otras propuestas de faunas evolutivas
Además de las faunas evolutivas propuestas por Sepkoski (Cámbrica, Paleozoica y Moderna), algunos autores han sugerido la existencia de dos más: la fauna de Ediacara, que comprende las primeras formas multicelulares complejas y precede a la explosión del Cámbrico, y la fauna Tommotiense, caracterizada por una diversidad inicial de organismos con conchas en el Cámbrico temprano (Fig. 2.13). La fauna de Ediacara representa un ecosistema único, mientras que la fauna Tommotiense muestra un incremento en la diversidad morfológica y adaptativa, con una expansión inicial seguida de un rápido declive. Estas faunas parecen seguir un patrón evolutivo en sucesión, donde cada una alcanza su diversificación máxima antes de entrar en declive. Posteriormente, las faunas Paleozoica y Moderna, cuyas raíces también se remontan al Cámbrico, no alcanzaron una diversidad significativa hasta períodos más avanzados.
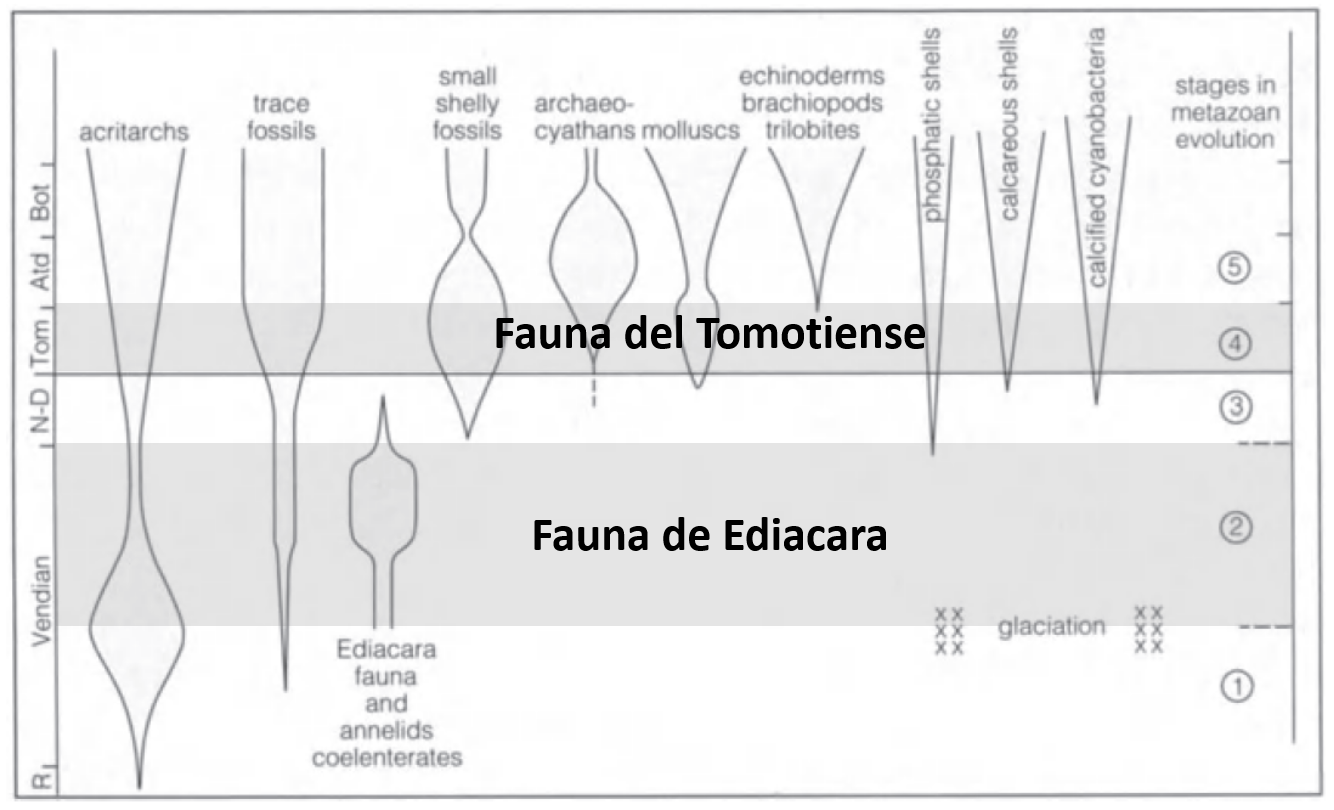
Figura 2.13: La Fauna de Ediacara y Fauna Tommotiense en el contexto de la evolución y extinción de grupos de metazoos en el Precámbrico tardío y el Cámbrico temprano. Abreviaturas de las etapas: N-D, Nemakit-Daldyniense; Tom., Tommotiense; Atd., Atdabaniense; Bot., Botomiense; R., Riphaense. Eventos evolutivos: 1) Diversificación de los Eukaryota; 2) diversificación y apogeo de la fauna de Ediacara; 3) aparición de los primeros fósiles con concha; 4) diversificación de la fauna de conchas pequeñas y otros grupos; 5) aparición de nuevos clados, incluyendo parte de la fauna del Cámbrico. Imagen tomada de Brenchley & Harper (1997)
Lectura recomendada
Brenchley, P. J., Brenchley, P., & Harper, D. (1997). Palaeoecology: Ecosystems, environments and evolution. CRC Press.
2.3.4 Escenarios alternativos al modelo logístico acoplado de diversificación
El modelo logístico acoplado, aunque efectivo para explicar ciertos patrones históricos de biodiversidad, no cuenta con una aceptación universal hoy en día. Existen alternativas que han ganado apoyo entre especialistas y han sido objeto de estudios recientes, que sugieren que la dinámica de diversificación podría seguir otros modelos, como el exponencial o un modelo logístico simple, ambos marcados por eventos de extinción en masa. Los estudios más recientes sobre la evolución de la diversidad han incorporado factores clave, como la variación regional en la diversificación, la capacidad de carga —el límite teórico de biodiversidad que un ambiente puede sostener antes de saturarse ecológicamente—, las extinciones masivas y varios modelos (logístico y exponencial). Estos análisis sugieren que, aunque la diversificación se ajusta a un modelo logístico, este se encuentra dentro de un régimen general de crecimiento exponencial. En particular, la relación entre diversidad y capacidad de carga indica que menos del 2% del área continental inundada global a lo largo del Fanerozoico presenta saturación ecológica, lo cual sugiere que en la mayoría de los ecosistemas no se ha alcanzado el límite de biodiversidad, permitiendo un crecimiento continuo sin las restricciones de la capacidad de carga. La diversificación global en el Mesozoico tardío y el Cenozoico parece estar impulsada por el desarrollo de “puntos críticos de diversidad” en períodos de estabilidad prolongada del sistema terrestre y máxima fragmentación continental, condiciones que crean nichos especializados y ecosistemas diversos. Esta “hipótesis de los puntos críticos de diversidad” constituye una alternativa no excluyente a la hipótesis de la revolución marina mesozoica como motor principal de la diversificación macroevolutiva postpaleozoica.
Lectura recomendada
Cermeño, P., García-Comas, C., Pohl, A., Williams, S., Benton, M. J., Chaudhary, C., … & Vallina, S. M. (2022). Post-extinction recovery of the Phanerozoic oceans and biodiversity hotspots. Nature, 607(7919), 507-511.
2.3.5 Observaciones de datos terrestres
Las dinámicas evolutivas en los medios terrestres revelan patrones heterogéneos en los que plantas y animales exhiben comportamientos distintivos en cuanto a su diversidad y tasas de reemplazamiento.
En cunto a los vertebrados terrestres (Fig. 2.14), se han observado dinámicas similares a las de los invertebrados marinos reflejando un patrón de reemplazo taxonómico que disminuye a lo largo del Fanerozoico. Esto sugiere la aparición de clados que son cada vez más resistentes a la extinción y longevos. Este fenómeno indica que, a lo largo de las eras geológicas, ciertas líneas evolutivas han logrado establecerse y perdurar, contribuyendo a una mayor estabilidad en la diversidad.
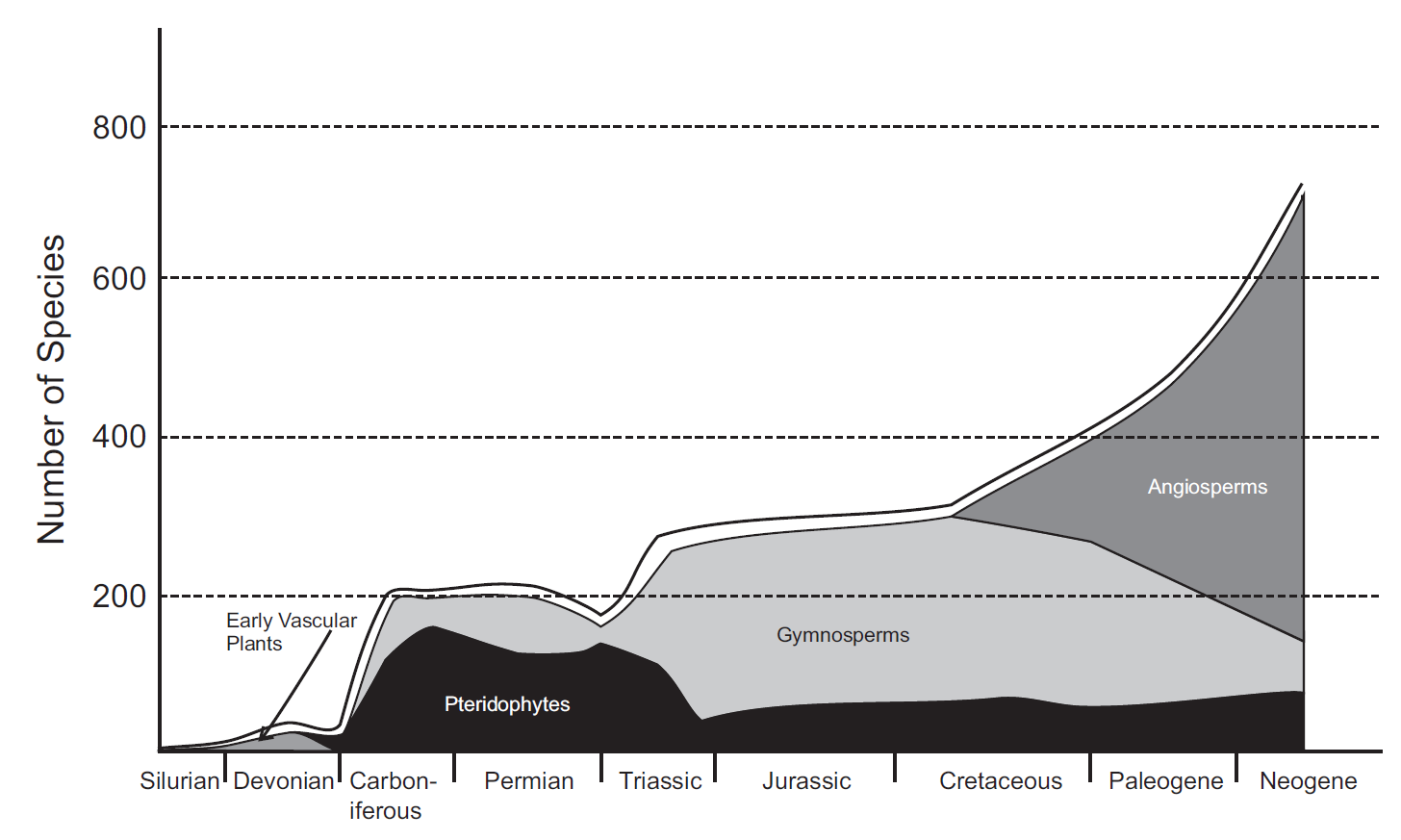
Figura 2.14: Cambios en la diversidad de especies a lo largo del tiempo de los principales grupos de plantas vasculares. La línea negra gruesa en la parte superior representa la diversidad total de especies, que incluye tanto plantas vasculares como no vasculares, así como aquellas clasificadas como incertae sedis. Imagen tomada de Cleal & Cascales-Miñana (2014)
Las plantas vasculares terrestres (Fig. 2.15), en contraste, presentan una dinámica de reemplazo taxonómico que aumenta a lo largo del Fanerozoico, lo que se asocia a clados que, en su mayoría, tienen vidas cada vez más cortas y son más propensos a la extinción. Un aspecto interesante de esta dinámica es que no se observa un decrecimiento en la diversidad asociado al reemplazamiento de floras evolutivas. Esto sugiere que, a pesar de la alta tasa de extinción, las plantas han mantenido una diversidad significativa a lo largo de su evolución, lo que desafía la noción de que los patrones de reemplazo deben seguir un modelo logístico acoplado.

Figura 2.15: Cambios en la diversidad de especies a lo largo del tiempo de los principales grupos de tetrapodos terrestres.Dentro de los grupos modernos se incluye a ranas, salamandras, lagartos, serpientes, tortugas, cocodrilos, aves y mamíferos. Imagen tomada de Cleal & Cascales-Miñana (2014)
Existen dos posibles explicaciones para estos patrones contrapuestos:
Lugares de Diversificación: La evolución de las faunas terrestres parece haber estado marcada por un origen común de clados con diferentes tasas de reemplazo taxonómico. Durante el Paleozoico temprano, una amplia gama de tasas de renovación estuvo presente en invertebrados marinos, sugiriendo que la diversificación inicial ocurrió en áreas cercanas a la costa. Los clados con altas tasas de renovación fueron los primeros en colonizar ambientes marinos más lejanos, mientras que aquellos con tasas más lentas se extendieron más tarde, reemplazando a los clados con tasas de renovación rápida. Además, los clados animales parecen haber irradiado desde entornos de alto estrés hacia entornos de bajo estrés, lo que refuerza la idea de que la capacidad de adaptación a diferentes condiciones ambientales jugó un papel crucial en su éxito evolutivo. En el caso de las plantas, la historia de su evolución también refleja un origen sucesivo de faunas con diferentes tasas de reemplazo taxonómico. A diferencia de los invertebrados, la gama completa de tasas de reemplazo en plantas terrestres no estuvo presente desde el principio. Las tasas de renovación evolucionaron a lo largo del tiempo con la aparición de grupos más derivados. Los clados de plantas con altas tasas de renovación aparentemente invadieron sucesivamente nuevos entornos terrestres. Los entornos estables y húmedos en tierras bajas actuaron como refugios evolutivos, mientras que la innovación y diversificación se produjeron en ambientes más exigentes en las tierras altas. Así, las distintas floras parecen irradiar desde entornos de bajo estrés hacia entornos de alto estrés.
Modo de Crecimiento y Desarrollo: Las diferencias en el modo de crecimiento y desarrollo entre plantas y animales también contribuyen a entender sus dinámicas evolutivas. Las plantas, generalmente estructuralmente más simples y con un crecimiento indeterminado, presentan una variabilidad estructural que permite la aparición secuencial de innovaciones en nuevos clados principales. En contraste, los animales, con ontogenias más precisas y críticas para la supervivencia, experimentan un proceso de renovación que tiende a ser dominado por la selección de linajes preexistentes. Esta complejidad ontogenética en animales puede resultar en una mayor vulnerabilidad a la extinción en clados menos adaptados, mientras que las plantas, con su capacidad de variación, pueden evolucionar innovaciones que les permitan adaptarse a cambios ambientales.
Lectura recomendada
Valentine, J. W., Tiffney, B. H., & Sepkoski Jr, J. J. (1991). Evolutionary dynamics of plants and animals: a comparative approach. Palaios, 81-88.
2.3.6 Las floras evolutivas
El análisis de la distribución global de familias de plantas vasculares a lo largo del tiempo revela un patrón complejo en la historia de la vegetación, que se puede entender a través de cinco principales Floras Evolutivas (Fig. 2.16). Cada una de estas floras representa etapas cruciales en la evolución de las plantas terrestres, reflejando no solo cambios en la composición de especies, sino también innovaciones evolutivas que han moldeado los ecosistemas a lo largo de la historia geológica.
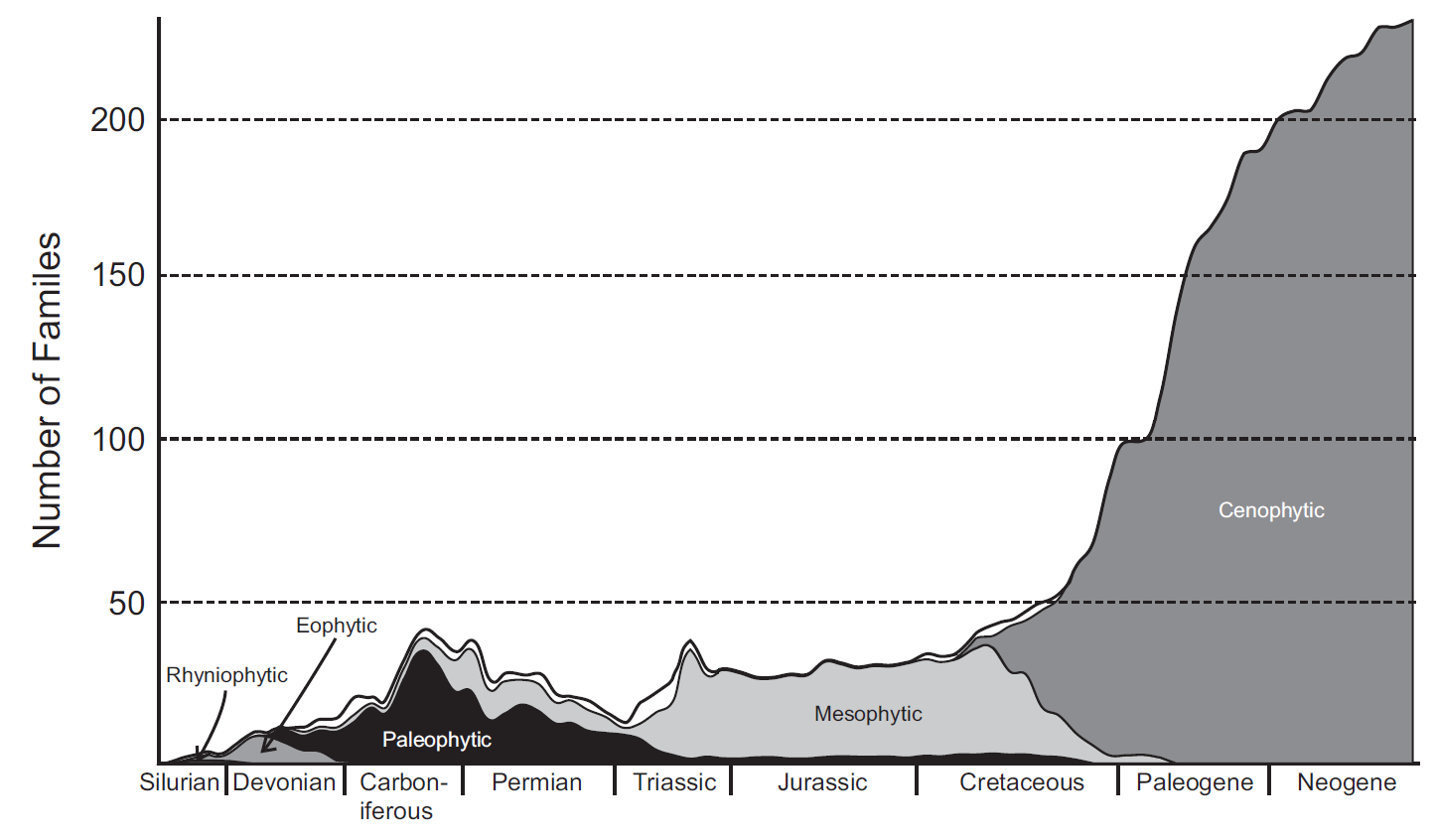
Figura 2.16: Cambios en la diversidad a nivel de familia dentro de cada una de las cinco Floras Evolutivas. La línea gruesa muestra la diversidad total de familias a lo largo del tiempo. El espacio en la parte inferior y el área sombreada representan la pequeña parte del patrón de diversidad total que no es explicada por el modelo. Imagen tomada de Cleal & Cascales-Miñana (2014).
La Flora Ryniophyta (o Eotrachiophyta) es la más temprana de estas floras, datando del Silúrico y el inicio del Devónico. Este grupo incluye principalmente las Rhyniophytopsida, que son consideradas las plantas vasculares más primitivas. Estas plantas, que aparecen en un contexto ecológico de colonización de hábitats terrestres, sentaron las bases para la posterior diversificación de las plantas vasculares.
La Flora Eofítica emergió en el Devónico temprano a medio, abarcando plantas terrestres tempranas que eran predominantemente homosporadas. Este grupo se caracteriza principalmente por las Zosterophyllopsida, Trimerophytopsida y las primeras Lycopsida. La aparición de estas plantas marca un importante avance en la adaptación a ambientes terrestres, proporcionando la base para ecosistemas más complejos y variados.
La Flora Paleofítica, que se desarrolla durante el Devónico tardío y el Carbonífero, se distingue por la introducción de la heterosporía, una innovación que permitió a las plantas producir dos tipos diferentes de esporas. Este desarrollo fue crucial para la evolución de las plantas, ya que facilitó la diversificación y la aparición de las primeras gimnospermas. La heterosporía representa un salto significativo en la complejidad reproductiva de las plantas, permitiendo una mayor adaptabilidad a diferentes condiciones ambientales.
Con la llegada del Carbonífero tardío y el Pérmico, surge la Flora Mesofítica, que aunque aparece más tarde en el registro macrofósil, muestra evidencia palinológica de que estas plantas existieron anteriormente en hábitats extra-basinales. Este grupo está dominado por gimnospermas con afinidades más modernas, representando una fase de madurez en la evolución de las plantas terrestres que introduce una mayor diversidad morfológica y funcional.
Finalmente, la Flora Cenofítica, que aparece por primera vez durante el Cretácico, está marcada por el dominio abrumador de las angiospermas. Este grupo no solo transformó los ecosistemas terrestres con su diversidad y adaptaciones, sino que también estableció nuevas interacciones ecológicas que aún son fundamentales en la actualidad.
Los eventos de extinción masiva al final del Devónico, del Triásico y del Cretácico, reconocidos en el registro fósil marino, parecen haber tenido poco impacto en la dinámica de diversidad de las Floras Evolutivas. En cambio, los cambios entre floras reflejan principalmente innovaciones evolutivas clave, como la heterosporía, la aparición de óvulos y la angiospermia (i.e., flores). Estas innovaciones no solo contribuyeron a la resiliencia de las plantas frente a extinciones masivas, sino que también impulsaron la diversificación y complejidad de los ecosistemas vegetales, destacando la importancia de la evolución en la historia de la vida en la Tierra.
Lectura recomendada
Cleal, C. J., & Cascales-Miñana, B. (2014). Composition and dynamics of the great Phanerozoic Evolutionary Floras. Lethaia, 47(4), 469-484.
2.4 Extinción
2.4.1 ¿Qué consideramos como extinción?
La extinción se define como la desaparición total de todos los miembros de una especie o grupo de taxones. Una especie se considera extinta desde el momento en que muere su último individuo. Este proceso puede ocurrir de dos maneras: una especie puede extinguirse sin dejar descendientes o, por el contrario, puede hacerlo dando lugar a otra especie, fenómeno conocido como pseudoextinción. Es importante destacar que este término ha adquirido un nuevo significado en el contexto de las extinciones recientes, refiriéndose a aquellos organismos que, tras ser considerados extintos por la comunidad científica, son posteriormente redescubiertos.
Se reconocen dos tipos de extinción. Por un lado, la extinción de fondo se refiere a la desaparición continua de especies a lo largo del tiempo geológico. Por otro lado, la extinción en masa se caracteriza por una rápida y generalizada disminución de la biodiversidad, que ocurre cuando la tasa de extinción supera significativamente la tasa de especiación, alejándose notablemente de la tasa de extinción de fondo. Estos conceptos de extinción de fondo y en masa se alinean respectivamente con las ideas originales sobre causas catastrofistas, defendidas por Cuvier y Brogniart, y con las teorías uniformistas promovidas por Darwin.
En un estudio fundamental publicado en 1982, Jack Sepkoski y David M. Raup (Fig. 2.17) identificaron cinco intervalos geológicos específicos con una pérdida excesiva de diversidad, que catalogaron como extinciones masivas:
- Ordovícico - Silúrico
- Devónico tardío (Frasniense-Fameniense)
- Pérmico - Triásico
- Triásico - Jurásico
- Cretácico - Terciario
Este estudio también reveló una tendencia general de disminución de las tasas de extinción de fondo durante el Fanerozoico, lo que sugiere un cambio en los patrones de extinción a lo largo de la historia geológica.
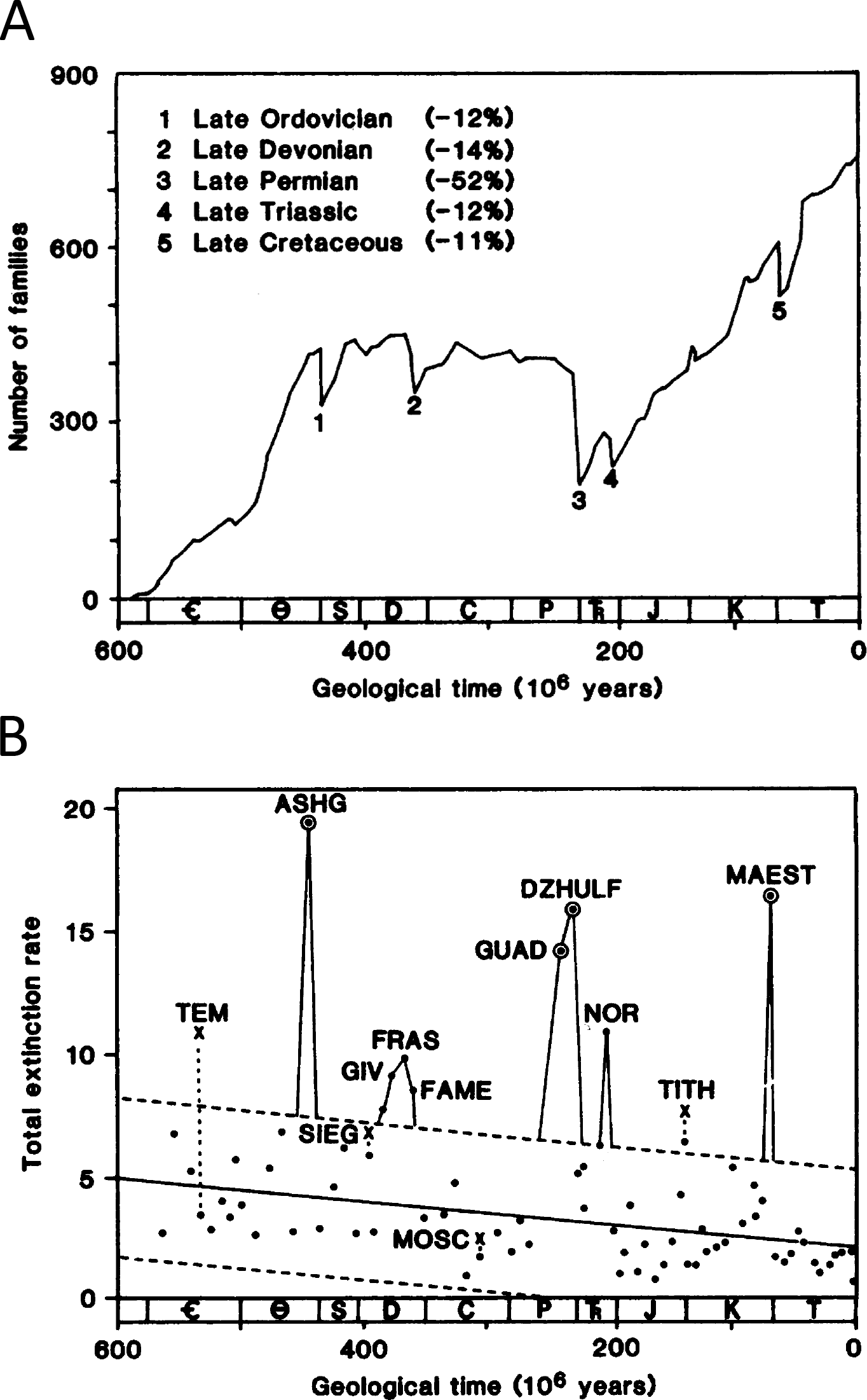
Figura 2.17: (A) Tasa total de extinción (extinciones por millón de años) a través del tiempo para familias de invertebrados y vertebrados marinos. El gráfico muestra extinciones masivas estadísticamente significativas al final del Ordovícico (ASHG), Pérmico (GUAD-DZHULF), Triásico (NOR) y Cretácico (MAEST). Un evento de extinción a finales del Devónico (GIV-FRAS-FAME) es notable, pero no estadísticamente significativo. Los puntos en círculo son aquellos donde la desviación del grupo principal es altamente significativa (P < 0.01); las X indican aquellos casos donde la inclusión de grupos de animales raramente preservados aumenta sustancialmente la tasa de extinción calculada (el punto directamente debajo de la X es la tasa calculada sin los grupos raramente preservados). El gráfico también muestra un descenso general en la tasa de extinción de fondo a lo largo del tiempo. La línea de regresión se ajusta a los 67 puntos con tasas de extinción inferiores a ocho familias TEM, Templetonense; ASHG, Ashgilense; SIEG, Siegenense; GIV, Givetense; FRAS, Frasnense; FAME, Famennense; MOSC, Moscoviense; GUAD, Guadalupense; DZHULF, Dzhulfense; NOR, Noriense; TITH, Tithonense; MAEST, Maestrichtense. (B) Diversidad existente a lo largo del tiempo para familias de vertebrados e invertebrados marinos. No se incluyen grupos raramente preservados. Se reconocen cinco extinciones masivas, indicadas por números, las cuales se manifiestan como caídas abruptas en la curva de diversidad. Las magnitudes relativas de estas caídas (medidas desde el período anterior hasta el período posterior al evento de extinción) se indican entre paréntesis en la parte superior izquierda. Imagen tomada de Raup & Sepkoski (1982).
2.4.2 Extinción de Fondo
2.4.2.1 ¿Por qué se extinguen las especies?
La extinción de fondo, o la tasa continua de extinción de especies a lo largo del tiempo, es un fenómeno natural que ocurre debido a diversos factores ecológicos, tanto internos como externos. Entre los principales impulsores de la extinción de fondo se encuentran:
Cambio Climático: Las variaciones en las temperaturas y patrones climáticos pueden alterar los hábitats y hacer insostenible la supervivencia de ciertas especies.
Pérdida de Hábitat: La destrucción de áreas naturales, debido a procesos naturales o antropogénicos, limita los espacios donde las especies pueden vivir, cazar, y reproducirse.
Desventajas Competitivas: Factores como la competencia con otras especies por los mismos recursos pueden llevar a la extinción de aquellas especies que no logran adaptarse a la presión de sus competidores.
La extinción de fondo puede ser tanto local (afectando solo a ciertas poblaciones de una especie) como global (provocando la desaparición completa de una especie). Además, puede afectar a la mayoría o todas las especies de una región, hábitat o ecosistema en particular, siendo un proceso que no siempre implica eventos cataclísmicos.
2.4.3 Las Hipótesis de la Reina Roja y del Bufón de la Corte
La extinción de fondo y la evolución misma están estrechamente ligadas a conceptos que explican los motores subyacentes de los cambios evolutivos. Las Hipótesis de la Reina Roja (Red Queen) y del Bufón de la Corte (Court Jester) destacan distintos factores que impulsan la evolución y el cambio en las especies a lo largo del tiempo.
2.4.3.1 Hipótesis de la Reina Roja
La Hipótesis de la Reina Roja es un concepto en biología evolutiva que enfatiza la competencia continua entre especies en un entorno en constante cambio. Para sobrevivir, las especies deben evolucionar constantemente, manteniendo así su posición relativa en un entorno donde otras especies también evolucionan de forma continua. Esta idea proviene de una cita del libro “A través del espejo y lo que Alicia encontró allí” de Lewis Carroll, donde la Reina Roja le dice a Alicia: “Aquí, necesitas correr tan rápido como puedas para quedarte en el mismo lugar”.
Este concepto fue popularizado por los biólogos evolutivos Leigh Van Valen y Graham Bell en la década de 1970. La analogía con la Reina Roja ilustra que, en un mundo cambiante, los organismos deben evolucionar solo para mantenerse en su posición actual, sin necesariamente obtener una ventaja evolutiva (carrera armamentística). La hipótesis destaca que la competencia entre especies es un motor clave de la evolución, en el que la presión evolutiva constante exige adaptaciones continuas para sobrevivir y reproducirse con éxito.
Hoy en día se reconocen tres modos principales de esta dinámica, según el tipo de selección y la arquitectura genética de los rasgos involucrados en la coevolución, que unifican tanto la selección fluctuante como la direccional dentro de este marco. La evidencia empírica respalda cada uno de estos modos de coevolución y sugiere que a menudo operan simultáneamente.
Reina Roja Fluctuante (Fluctuating Red Queen, FRQ) En este modo, la selección cambia continuamente y hace que las frecuencias de ciertos alelos (variantes genéticas) oscile. Aquí, la interacción requiere una correspondencia precisa de rasgos controlados por pocos genes en ambos organismos (por ejemplo, un parásito y su huésped). Esto genera una ventaja para los genotipos raros de la especie víctima, ya que los depredadores o parásitos persiguen los genotipos más comunes. Como resultado, las poblaciones mantienen su diversidad genética, ya que los alelos de ambas especies se enfrentan a ciclos de oscilaciones dependientes de la frecuencia, donde la frecuencia de un alelo disminuye a medida que se vuelve común y aumenta cuando es raro. Imaginemos un parásito y su huésped (la “víctima”) que se adaptan mutuamente, pero lo hacen en una especie de “danza” de cambios continuos. Cada vez que el parásito se adapta para atacar mejor al huésped, este último se adapta para defenderse. Lo importante es que los cambios en ambos se parecen a una especie de “juego de escondite”: cuando la defensa del huésped cambia, el parásito persigue ese cambio, pero en cuanto el parásito se adapta de nuevo, el huésped vuelve a variar. Esto mantiene muchos tipos de defensas (alelos) en la población porque siempre hay algunos que se vuelven menos “interesantes” para el parásito en cada ciclo de adaptación.
Reina Roja Escalonada (Escalatory Red Queen, ERQ) Aquí, la selección es direccional, lo que significa que ambas especies desarrollan características cada vez más extremas en una “carrera armamentística evolutiva”. Cada especie intenta “superar” los rasgos de la otra, como en una carrera continua de mejoras. Por ejemplo, un depredador puede desarrollar dientes más fuertes, mientras su presa desarrolla caparazones más duros. Esta carrera no es necesariamente infinita, ya que puede llegar a un equilibrio estable o incluso hacer que una de las especies se extinga, deteniendo el proceso de coevolución. No obstante, si el aumento de rasgos se ve limitado por costos o restricciones, es posible que después de un período de escalada ocurra una fase de desescalada.
Reina Roja de Persecución (Chase Red Queen, CRQ) En este caso, la selección direccional local impulsa una “persecución” coevolutiva entre un explotador y su víctima, donde ambos evolucionan constantemente a lo largo de un espacio fenotípico multidimensional. Este modo suele tener una base genética más compleja, permitiendo múltiples maneras de respuesta en distintas dimensiones del fenotipo. Las víctimas tienden a diversificar sus características para evadir a los explotadores, mientras que estos últimos intentan reducir la distancia fenotípica y “atraparlas”. Este modo implica barridos selectivos sucesivos que disminuyen la diversidad genética dentro de cada población, pero que aumentan la divergencia entre poblaciones. Este modo es más caótico y se parece a una “persecución sin fin”, en la que el huésped no solo cambia en un aspecto simple (como una defensa básica) sino en varios aspectos a la vez, explorando muchas maneras de escapar del parásito. Aquí, la persecución es más “creativa”: el huésped intenta todo tipo de combinaciones para alejarse del parásito, y este último sigue intentando acortar la distancia adaptándose a cada nueva combinación. Este “juego de persecución” crea variedad, pero va agotando la diversidad dentro de cada población mientras aumenta las diferencias entre distintos grupos (por ejemplo, en distintas regiones).
La FRQ y la CRQ pueden parecer equivalntes pero tienen diferencias fundamentales. La FRQ es más un juego de “cambio constante, pero en círculo”, donde ambos siguen los mismos patrones de adaptación uno tras otro. La CRQ, en cambio, es un “juego de exploración” donde el huésped y el parásito prueban muchos caminos diferentes de adaptación, llevándolos a desarrollar variaciones más complejas y menos predecibles.
Lectura recomendada
Brockhurst, M. A., Chapman, T., King, K. C., Mank, J. E., Paterson, S., & Hurst, G. D. (2014). Running with the Red Queen: the role of biotic conflicts in evolution. Proceedings of the Royal Society B: Biological Sciences, 281(1797), 20141382.
Pearson, P. N. (2001). Red queen hypothesis. e LS.
Solé, R. (2022). Revisiting leigh van valen’s “A new evolutionary law”(1973). Biological Theory, 17(2), 120-125.
Strotz, L. C., Simoes, M., Girard, M. G., Breitkreuz, L., Kimmig, J., & Lieberman, B. S. (2018). Getting somewhere with the Red Queen: chasing a biologically modern definition of the hypothesis. Biology letters, 14(5), 20170734.
2.4.3.2 Hipótesis del Bufón de la Corte
En contraste con la Reina Roja, la Hipótesis del Bufón de la Corte sugiere que los factores abióticos, como el cambio climático, los eventos tectónicos, o incluso el impacto de asteroides, son los principales impulsores de la evolución en una escala macroevolutiva, más que la competencia entre especies. Esta hipótesis, introducida por Anthony Barnosky en 1999 y 2001, toma su nombre de la figura del “bufón” de las cortes medievales, que representa la imprevisibilidad y el caos en un entorno generalmente estable y ordenado. Así, esta hipótesis sugiere que eventos externos y aleatorios alteran abruptamente las reglas del juego para las especies y ecosistemas, introduciendo cambios significativos y nuevos escenarios evolutivos.
Según Barnosky, la Hipótesis del Bufón de la Corte explica que el registro fósil documenta cambios morfológicos y de composición de especies a través del tiempo, impulsados más por perturbaciones aleatorias del ambiente físico que por interacciones bióticas. Esto se puede resumir en la idea de que eventos externos e impredecibles, “aleatorios” para las especies, pueden alterar el “campo de juego” evolutivo, provocando una respuesta acelerada en las especies afectadas.
Lectura recomendada
Barnosky, A. D. (2001). Distinguishing the effects of the Red Queen and Court Jester on Miocene mammal evolution in the northern Rocky Mountains. Journal of Vertebrate Paleontology, 21(1), 172-185.
2.4.3.3 Escalas temporales y geográficas de ambos modelos evolutivos
Existe un debate abierto sobre si estos modelos evolutivos afectan a diferentes escalas geográficas y temporales o si actuan conjuntamente. Algunos investigadores apoyan la idea de que la competencia, la depredación y otros factores bióticos moldean los ecosistemas de manera local y en periodos cortos de tiempo, mientras que factores extrínsecos como el clima y los eventos oceanográficos y tectónicos moldean patrones a mayor escala, tanto regional como globalmente, y a lo largo de miles y millones de años. Segun estos autores los estudios paleobiológicos sugieren que la diversidad de especies está impulsada en gran medida por factores abióticos como el clima, el paisaje o la disponibilidad de alimentos, y los enfoques filogenéticos comparativos ofrecen nuevas perspectivas sobre la dinámica de los clados. Otros autores apoyan la idea de que ademas de la Reina Roja, otros fenomenos de origen biotico pueden causar cambio macroevolutivo incluso en ausencia de cambio ambiental. Estos factores incluyen patrones de expansión y colapso caracterizado por un lento proceso de acumulación evolutiva y el colapso ocasional de ecosistemas inherentemente frágiles (relacionado con el concepto de criticalidad autoorganizada); evolucion de innovaciones clave seguidas de radiaciones y reemplazos de clados; y fenomenos de escalación.
Lectura recomendada
Benton, M. J. (2009). The Red Queen and the Court Jester: species diversity and the role of biotic and abiotic factors through time. Science, 323(5915), 728-732.
Vermeij, G. J. (2013). On escalation. Annual Review of Earth and Planetary Sciences, 41(1), 1-19.
Voje, K. L., Holen, Ø. H., Liow, L. H., & Stenseth, N. C. (2015). The role of biotic forces in driving macroevolution: beyond the Red Queen. Proceedings of the Royal Society B: Biological Sciences, 282(1808), 20150186.
2.4.3.4 Conceptos Adyacentes: Hipótesis del Rey Rojo y Reina Negra
En el contexto de la evolución y la interacción entre especies, existen otros conceptos con nombres similares que conviene conocer, aunque no sean relevantes en este caso. Entre ellos están la Hipótesis del Rey Rojo y la Hipótesis de la Reina Negra, que exploran dinámicas evolutivas y adaptativas en marcos distintos al de la Reina Roja y el Bufón de la Corte. La mención de estos términos busca únicamente evitar posibles confusiones terminológicas.
2.4.3.4.1 Hipótesis del Rey Rojo
La Hipótesis del Rey Rojo propone que, en interacciones mutualistas o cooperativas, las especies pueden beneficiarse de una evolución más lenta en comparación con una “carrera armamentista” competitiva. En lugar de competir, las especies establecen interacciones positivas a largo plazo, como el mutualismo, que favorecen la estabilidad y evitan la necesidad de cambios rápidos. Esta hipótesis plantea que, en este tipo de relaciones, los individuos de una especie pueden adaptarse a las necesidades de otra, estableciendo un nicho compartido. Además, en algunos casos, la interacción puede ser lo suficientemente estable como para que las especies reduzcan sus esfuerzos en competir y en su lugar, optimicen su eficiencia y resiliencia al estrés ambiental.
Lectura recomendada
Bergstrom, C. T., & Lachmann, M. (2003). The Red King effect: when the slowest runner wins the coevolutionary race. Proceedings of the National Academy of Sciences, 100(2), 593-598.
2.4.3.4.2 Hipótesis de la Reina Negra
La Hipótesis de la Reina Negra explora cómo la evolución puede favorecer la pérdida de funciones biológicas en comunidades microbianas. Según esta hipótesis, en una comunidad donde ciertos miembros producen recursos de manera accesible para otros, algunos organismos pueden perder la capacidad de producir estos recursos ellos mismos, aprovechándose de los esfuerzos de los demás. Así, estos microorganismos logran conservar energía y simplificar su genoma, aumentando la eficiencia en su replicación. La Hipótesis de la Reina Negra sugiere que la selección natural puede favorecer la pérdida de genes o funciones en contextos en los que el acceso a recursos compartidos permite que ciertas especies sobrevivan sin la necesidad de producir todos los compuestos necesarios por sí mismas.
Lectura recomendada
Morris, J. J., Lenski, R. E., & Zinser, E. R. (2012). The Black Queen Hypothesis: evolution of dependencies through adaptive gene loss. MBio, 3(2), 10-1128.
Morris, J. J. (2015). Black Queen evolution: the role of leakiness in structuring microbial communities. Trends in Genetics, 31(8), 475-482.
2.4.4 Vulnerabilidad a la extinción y selectividad
La extinción de especies es un fenómeno complejo que se desarrolla a lo largo de escalas de tiempo ecológicas y geológicas, y rara vez es un proceso aleatorio. Algunas especies presentan una mayor propensión a la extinción que otras, y esta vulnerabilidad puede atribuirse a diversos rasgos que determinan su capacidad de supervivencia. Entre ellos, la especialización, el tamaño corporal, el rango geográfico, la abundancia y las restricciones filogenéticas y ecológicas son factores clave que influyen en el riesgo de extinción (Fig. 2.18).

Figura 2.18: Características biológicas citadas en la literatura ecológica y paleontológica como factores que incrementan el riesgo de extinción. Símbolos: ++ = numerosas citas identificadas, + = al menos una cita identificada, - = ninguna cita identificada hasta el momento. Imagen tomada de McKinney (1997).
La especialización se refiere a la adaptación de una especie a un nicho específico, lo que puede incrementar su susceptibilidad a la extinción. Los organismos altamente especializados suelen tener un rango limitado de tolerancia a cambios ambientales, haciéndolos más vulnerables a alteraciones en su hábitat. En el ámbito paleontológico, se ha observado que los taxones tropicales suelen tener tasas de recambio evolutivo más altas, sugiriendo que la especialización podría estar relacionada con una mayor rotación en estas comunidades. Además, la evidencia paleontológica indica que las especies euritópicas (generalistas) y aquellas con nichos estrechos suelen tener longevidades (rangos estratigráficos) más prolongadas.
El rango geográfico es otro factor que influye en la vulnerabilidad a la extinción. Las especies con rangos geográficos más limitados tienden a presentar una menor abundancia local, lo que agrava su vulnerabilidad ante cambios ambientales. Las especies con rangos amplios, por el contrario, pueden tener mayor capacidad para adaptarse a cambios en su hábitat y, por ende, una menor probabilidad de extinción.
El tamaño corporal es otro rasgo frecuentemente asociado con la vulnerabilidad a la extinción. En ecología y paleontología, se ha documentado que un gran tamaño corporal puede favorecer la extinción, especialmente en animales terrestres. Algunos investigadores consideran que el tamaño grande es una forma de especialización, mientras que otros lo ven como un correlato de la especialización, en particular en el contexto del paradigma r-K. Sin embargo, estudios más recientes sobre el registro fósil marino revelan un patrón contrario, donde las especies más pequeñas han mostrado una mayor propensión a la extinción a lo largo de extensos períodos geológicos.
La abundancia es quizás el predictor más destacado de la probabilidad de extinción, ya que una baja abundancia suele estar asociada con un mayor riesgo de extinción en escalas ecológicas y, posiblemente, geológicas. La abundancia está influenciada por una combinación de rasgos individuales que determinan la supervivencia y reproducción, así como por las condiciones ambientales. Aunque existe una fuerte relación entre abundancia y riesgo de extinción, también hay excepciones significativas. La evidencia del registro fósil en este sentido es limitada, dado que la abundancia es un parámetro difícil de inferir. Cuando ha podido ser cuantificada, se ha documentado un efecto indirecto negativo de ésta sobre el riesgo de extinción.
Por otro lado, las restricciones filogenéticas influyen de manera no aleatoria en la vulnerabilidad a la extinción de especies y poblaciones, dado que características como el tamaño corporal, la abundancia y el rango ecológico poseen componentes genéticos que pueden concentrar rasgos predisponentes en ciertos taxones por el simple hecho de tener una ascendencia común. Se han documentado diferencias consistentes en las tasas de extinción entre grupos de alto rango, como clases y órdenes, con evidencia fósil que sugiere que ciertos grupos son menos susceptibles a la extinción. En particular, los taxones marinos tienden a ser menos vulnerables que los terrestres, probablemente debido a su mayor amplitud geográfica. Aunque comparar tasas de extinción en taxones inferiores es complicado, se ha observado que carnívoros tienen tasas de extinción más altas.
Lectura recomendada
Harnik, P. G. (2011). Direct and indirect effects of biological factors on extinction risk in fossil bivalves. Proceedings of the National Academy of Sciences, 108(33), 13594-13599.
Kammer, T. W., Baumiller, T. K., & Ausich, W. I. (1997). Species longevity as a function of niche breadth: evidence from fossil crinoids. Geology, 25(3), 219-222.
McKinney, M. L. (1997). Extinction vulnerability and selectivity: combining ecological and paleontological views. Annual review of ecology and systematics, 495-516.
Powell, M. G. (2007). Geographic range and genus longevity of late Paleozoic brachiopods. Paleobiology, 33(4), 530-546.
2.4.5 ¿Hay correlación entre la vulnerabilidad de las poblaciones y la de la especie?
La relación entre la vulnerabilidad de las poblaciones y la de las especies es un tema recurrente en los textos de conservación, que a menudo sugieren una correlación entre ambas. Sin embargo, este supuesto no siempre se examina con el debido rigor. Por un lado, rara vez se hace una distinción clara entre la vulnerabilidad poblacional y la vulnerabilidad a nivel de especie. Además, la dinámica de metapoblaciones plantea que las especies con un alto recambio poblacional pueden, al menos en teoría, experimentar un recambio de especies relativamente bajo. Es decir, una especie puede persistir a pesar de la extinción local de algunas de sus poblaciones, lo que complica la interpretación de esta relación.
A pesar de la complejidad de este fenómeno, tres líneas de evidencia sugieren que el riesgo poblacional generalmente se correlaciona con el riesgo a nivel de especie. En primer lugar, muchas especies dependen de una o pocas grandes poblaciones continentales o de “fuente” para su persistencia. En lugar de presentar estructuras metapoblacionales clásicas, donde existen parches de población en equilibrio entre extinciones locales y recolonizaciones, la persistencia de las especies parece estar anclada en estas grandes poblaciones que son capaces de rastrear y adaptarse a los cambios ambientales. Por ende, la vulnerabilidad de estas poblaciones fuente podría ser un indicador fiable del riesgo de extinción a nivel de especie.
En segundo lugar, se ha documentado que las especies con mayor vulnerabilidad tienden a ser las primeras en extinguirse localmente. Este patrón se evidencia en el hecho de que las especies más amenazadas, como ciertos primates y aves, no solo enfrentan un alto riesgo de extinción global, sino que también son las primeras en desaparecer de las comunidades locales.
Finalmente, muchos de los rasgos que incrementan el riesgo de extinción en poblaciones, como la especialización y la rareza, también parecen ser factores determinantes en las tasas de extinción entre especies y taxones superiores. Por ejemplo, se ha observado que una baja tasa intrínseca de crecimiento poblacional, junto con ciclos de vida largos y longevidades extensas, contribuyen a las altas tasas de extinción entre poblaciones y especies de primates. Estos rasgos sugieren que la vulnerabilidad poblacional y la de especie no son fenómenos independientes, sino que están interrelacionados de manera significativa, lo que implica que abordar la conservación desde una perspectiva poblacional puede ofrecer insights valiosos para la preservación de la biodiversidad en un contexto más amplio.